题目内容
【题目】称取12.5g石灰石(主要成分CaCO3,杂质不参与反应)放入50.0g稀盐酸中,二者恰好完全反应.反应结束后称得剩余物质的总质量为58.1g.试计算所用稀盐酸中溶质的质量分数.
【答案】14.6%
【解析】
碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳气体质量,据此根据反应的化学方程式列式计算出参加反应盐酸的质量,进而计算出所用稀盐酸的溶质质量分数
解:由质量守恒定律,反应完全后,产生气体的总质量为12.5g+50g﹣58.1g=4.4g;
设所用稀盐酸的溶质质量为x,
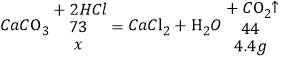
![]()
x=7.3g,
所用稀盐酸的溶质质量分数是![]() 100%=14.6%;
100%=14.6%;
答:所用稀盐酸的溶质质量分数是14.6%。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案
相关题目
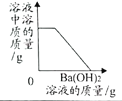
【题目】下列图像分别表示4个实验的过程中,其中图像与对应实验相符合的是
|
|
|
|
A.向一定质量稀H2SO4中加入Ba(OH)2至恰好中和 | B.将一定质量的不饱和KNO3溶液恒温蒸发至有晶体析出 | C.向等质量的金属Fe和Zn中分别加入等浓度的稀盐酸 | D.CuO和C的固体混合物在高温下反应 |
A. AB. BC. CD. D