题目内容
【题目】金属在日常生活中有着广泛的用途。常见金属的活动性顺序如下:

请回答下面问题:
(1)金属活动性顺序表中的X是_____元素。(填元素符号)
(2)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,该反应的化学方程式为_____。
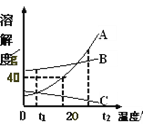
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图2所示。图中B点溶液中含有的溶质有_____。
(4)非金属单质也具有类似金属与盐溶液之间发生置换反应的规律,即活动性较强的非金属可把活动性较弱的非金属从其盐酸溶液中置换出来,如在溶液中可发生下列反应:Cl2+2NaBr═2NaCl+Br2、I2+Na2S═2NaI+S↓、Br2+2KI═2KBr+I2由此判断S、Cl2、I2、Br2四种单质中非金属活动性最强的是_____。
【答案】Hg 2Al+3CuSO4=3Cu+Al2(SO4)3 Cu(NO3)2、Zn(NO3)2 Cl2
【解析】
(1)根据金属的活动性顺序为:K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au可知,金属活动性顺序表中的X是Hg元素。故答案为:Hg。
(2)在金属活动性顺序中,铝在铜的前面,能与硫酸铜反应生成铜,化学方程式为:2Al+3CuSO4=3Cu+Al2(SO4)3;故答案为:2Al+3CuSO4=3Cu+Al2(SO4)3。
(3)在金属活动性顺序中,Zn>Cu>Ag,向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,与两种溶质依次发生反应
![]()
所以析出银的过程是溶液质量减少的过程;
![]()
所以析出铜的过程是溶液质量增加的过程
B点时锌与AgNO3恰好完全反应,没有与Cu(NO3)2反应,此时溶液中含有Cu(NO3)2、Zn(NO3)2;故答案为:Cu(NO3)2、Zn(NO3)2。
(4)由题意可知,非金属单质也具有类似金属与盐溶液之间发生置换反应的规律,活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来,由Cl2+2NaBr=2NaCl+Br2;I2+Na2S=2NaI+S↓;Br2+2KI=2KBr+I2可以判断出S、Cl2、I2、Br2活动性由强到弱的顺序是Cl2>Br2>I2>S.所以非金属活动性最强的是Cl2。
故答案为:Cl2。

【题目】实验小组对过氧化氢的某些性质进行探究
(查阅资料)过氧化氢是一种受热易分解的物质,某些漂白液中含有过氧化氢溶液,过氧化氢溶液可漂白一些有色物质
(进行实验)
实验A:室温下用10%的过氧化氢溶液浸泡一块红色布条(如图所示),浸泡时间与布条颜色变化如下表
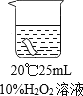
浸泡时间 | 20min | 40min | 60min |
布条颜色的变化 | 无明显变化 | 颜色稍变浅 | 颜色明显变浅 |
实验B:改变实验条件再进行4次实验,现象如下表
编号 | ① | ② | ③ | ④ |
实验条件 | 20℃25mL 10%H2O2溶液 | 50℃25mL 10%H2O2溶液 | 20℃25mL 10%H2O2溶液 +2mLNaOH溶液 | 50℃25mL 10%H2O2溶液 +2mLNaOH溶液 |
布条颜色的变化 (20min) | 无明显变化 | 颜色稍变浅 | 颜色稍变浅 | 颜色明显变浅 |
(1)实验A的结论是_____
(2)实验B中,欲得出“其他条件相同时,升高温度可使过氧化氢溶液的漂白性增强”的结论,需要对比实验_____(填编号)
(3)实验B中,通过对比②④,得出的结论是_____
(4)更多的实验结果表明,漂白液的使用温度不宜过高,推测其原因是_____
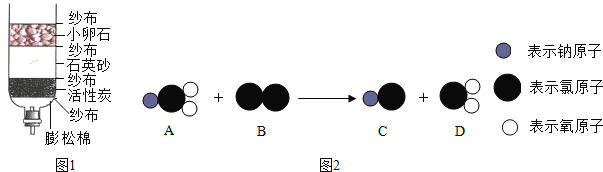
【题目】我们常用如图1下列装置进行实验:
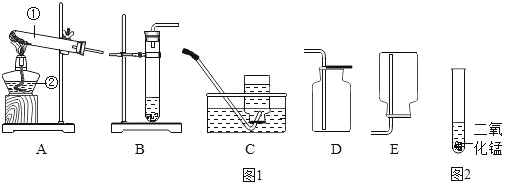
(1)写出上列仪器的名称①_____②_____
(2)完成三种实验室制取氧气的化学方程式,并选择对应的实验室制取氧气的发生装置和收集装置(填字母编号,下同)。
完成下列化学反应的化学方程式 | 发生装置 | 收集装置 |
①高锰酸钾_____ | _____ | _____ |
②氯酸钾_____ | _____ | _____ |
③过氧化氢_____ | _____ | _____ |
(3)实验室制CO2的化学方程式是_____,实验室制取H2的化学方程式是_____。
(4)实验室常用加热固体甲和固体乙的混合物来制取气体丙,则制取丙选用的发生装置是_____;若收集气体丙时只能用E装置,则可推知丙的性质可能有_____。
(5)某学生学习了双氧水制氧气的实验后,想起自己家里也有一瓶消毒用双氧水,由于标签已部分受损无法判断其是否变质,所以他将该瓶溶液带到学校,进行了如图2所示的研究。试回答:
①放入二氧化锰的作用是_____。
②如果该溶液未变质,应该观察到的现象是_____,若不能观察到上述现象,说明该瓶双氧水已经变质成_____。
③将未过期的这种双氧水滴在伤口上,会迅速出现大量气泡,你认为该气体是_____。