题目内容
【题目】某学校的化学兴趣小组为了测定一份石灰石样品的纯度,取出2.5g石灰石样品(样品中杂质不溶于水,且不参与反应)并粉碎,然后逐渐加入稀盐酸,充分反应后剩余固体与加入稀盐酸的质量关系如图所示。

(1)石灰石样品粉碎的目的是______。
(2)石灰石样品的纯度是______。
(3)求生成的二氧化碳气体的质量_____(写出计算过程)。
【答案】增大反应物的接触面积,利于充分反应 80% 0.88g
【解析】
碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,根据题意:样品中杂质不溶于水,且不与酸反应,由剩余固体质量与加入稀盐酸的质量关系图,当加入稀盐酸的质量为10g时,恰好完全反应,此时剩余固体即为样品中的杂质,则样品中碳酸钙的质量为2.5g-0.5g=2g,由反应的化学方程式,列式计算出生成氯化钙的质量、生成二氧化碳的质量,进而计算出溶质的质量分数,据此进行分析解答。
(1)石灰石样品粉碎的目的是增大反应物的接触面积,利于充分反应;
(2)根据题意,石灰石样品的质量为2.5g,当加入稀盐酸的质量为10g时,恰好完全反应,此时剩余固体即为样品中的杂质,则样品中碳酸钙的质量为2.5g-0.5g=2g;石灰石样品的纯度是![]() ×100%=80%;
×100%=80%;
(3)设生成二氧化碳气体的质量为x,
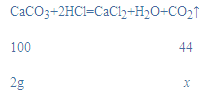
![]()
x=0.88g。

 名校课堂系列答案
名校课堂系列答案【题目】某兴趣小组在实验室里准备常见酸、碱、盐的性质实验时,发现实验台上摆放的药品中,有一瓶未盖瓶塞且标签破损的溶液(如图),他们决定对这瓶溶液的成分进行探究。

(提出问题)这瓶溶液的溶质是什么?
(获得信息)
①酸、碱、盐的性质实验中用到含钠元素的物质有氯化钠、氢氧化钠、碳酸钠、碳酸氢钠。
②实验室里盛放碱性溶液的试剂瓶通常使用橡胶塞。
③氯化钡溶液呈中性。
(提出猜想)猜想一:氢氧化钠:猜想二:碳酸钠:猜想三:碳酸氢钠。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
取一支洁净试管,加入待测液,然后滴加过量稀盐酸 | 有 ______ 产生 | 该溶液的溶质是碳酸钠或者是 ______ |
再取一支洁净试管,加入待测液,后加入过量的氯化钡溶液 | 有白色沉淀产生 | 该溶液的溶质是 ______ ,发生 反应的化学方程式为 ______ |
小华认为上面的结论不完全正确,理由是______(用化学方程式表示);小组讨论后,又进行如下实验:
取第二次实验后的上层清液,滴入无色酚酞试液,溶液呈红色。
(实验结论)这瓶溶液的原溶质是氢氧化钠。
(交流反思)实验探究中,能否用氢氧化钡溶液替代氯化钡溶液?______(填“能”或“不能”):实验中取用液体药品时,应注意密封保存。