题目内容
【题目】实验课上,为检验镁条能否在N2中燃烧,某兴趣小组开展如下探究:
(查阅资料)氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;NH3能使湿润红色石蕊试纸变蓝色。
(实验步骤)
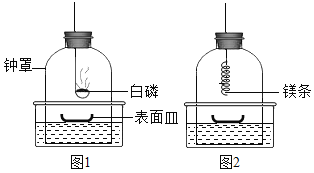
①将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
②待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
③打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
④待钟罩内水面不再变化时,观察钟罩内壁及表面皿中固体颜色,取少量固体加入水中。
(分析)
(1)步骤①中足量白磷在钟罩内燃烧的目的是_____;
(2)步骤②向水槽中加水,使水槽中液面与钟罩内液面相平的目的是_____;
(3)步骤③中镁条剧烈燃烧,反应的化学方程式为_____;
(4)步骤④中钟罩内壁及表面皿中出现淡黄色固体,加入水中,产生能使湿润红色石蕊试纸变蓝色的气体,反应的化学方程式为_____;
(结论)镁能在N2中燃烧,并生成Mg3N2。
(5)我们在做镁条在空气中燃烧的实验时,发现其产物主要呈白色。请你判断:2.40g镁条在某充满空气的密闭容器中完全燃烧,所得固体质量可能为_____。
A 3.33g B 3.93g C 4.00g D 3.96g
【答案】充分除去钟罩内的氧气 使钟罩内外压强一致,防止空气进入 3Mg+N2![]() Mg3N2 Mg3N2+6H2O=3Mg(OH)2+NH3↑ BD
Mg3N2 Mg3N2+6H2O=3Mg(OH)2+NH3↑ BD
【解析】
(1)步骤①中足量白磷在钟罩内燃烧的目的是充分除去钟罩内的氧气,使氮气更好的和镁条反应;
(2)步骤②向水槽中加水,使水槽中液面与钟罩内液面相平的目的是使钟罩内外压强一致,防止空气进入;
(3)此时装置内没有氧气,故镁条燃烧反应的化学方程式为:3Mg+N2![]() Mg3N2;
Mg3N2;
(4)根据已知资料氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;NH3能使湿润红色石蕊试纸变蓝色,故反应化学方程式为:Mg3N2+6H2O=3Mg(OH)2+NH3↑;
(5)根据质量守恒定律,设2.4g镁全部和氧气反应,则生成氧化镁的质量为: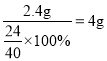 ,设2.4g镁全部和氮气反应,则生成氮化镁的质量为:
,设2.4g镁全部和氮气反应,则生成氮化镁的质量为: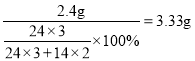 ,因此2.40g镁条在某充满空气的密闭容器中完全燃烧,所得固体质量应大于3.33g,小于4g,选BD。
,因此2.40g镁条在某充满空气的密闭容器中完全燃烧,所得固体质量应大于3.33g,小于4g,选BD。

 阅读快车系列答案
阅读快车系列答案【题目】教材中采用如图所示装置测定空气中氧气的含量。
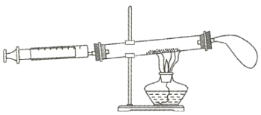
实验步骤:
①将一支硬质玻璃管注满水(两端用橡皮塞封住),然后打开上端橡皮塞,将水倒入量筒中,记录体积为![]()
②在另一支相同规格的硬质玻璃管中装入铜粉,两端塞上带玻璃导管的橡皮塞,其中一端用气球密封。移动注射器活塞,在注射器中留下一定体积的气体,记录体积![]() 后与硬质玻璃管另一端密封连接。根据酒精灯的高度,将玻璃管固定在铁架台上。
后与硬质玻璃管另一端密封连接。根据酒精灯的高度,将玻璃管固定在铁架台上。
③用酒精灯在铜粉部位加热,加热时不断推拉注射器活塞。
④停止加热后,待玻璃管冷却至室温将气球内的气体全部挤出,待注射器活塞稳定后,记录注射器中气体的体积为![]() 。
。
请填空:
(1)该实验中反应的文字表达式为________________________。
(2)步骤③中“加热时不断推拉注射器活塞”的目的是________________。
(3)数据处理:(用含“![]() ”“
”“![]() ”或“
”或“![]() ”的式子填空)
”的式子填空)
反应前密闭系统 内的气体总体积 | 反应后密闭系统 内的气体总体积 | 本实验中反应 消耗的氧气体积 |
_______________ | _______________ | _______________ |
该实验测定的空气中氧气的体积分数为______。
(4)本实验中的铜粉是否可用木炭代替?______(选填“是”或“否”)。
【题目】密闭容器内有四种物质,测得反应前后各物质的质量如下表。下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前质量∕g | 8 | 2 | 40 | 5 |
反应后质量∕g | 待测 | 24 | 8 | 23 |
A. 该反应一定是置换反应B. 乙和丁的相对分子质量比一定为11 : 9
C. 参加反应的甲、丙的质量比为1 : 4D. 反应后甲的质量为8克
【题目】除去下列物质中的少量杂质(括号内为杂质),所用除去杂质的方法不正确的是( )
选项 | 待提纯的物质 | 除去杂质的方法 |
A | CO(CO2) | 足量氢氧化钙溶液 |
B | CO2(CO) | 将混合气体点燃 |
C | N2(O2) | 通过灼热的铜网 |
D | CuO(Cu) | 通入足量的氧气并加热 |
A. AB. BC. CD. D