题目内容
 A-K是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,G、H为气态单质,I在常温下为液体,D、E、F的水溶液均呈碱性,由C的饱和溶液制取F或E是重要的化工生产.回答下列问题:
A-K是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,G、H为气态单质,I在常温下为液体,D、E、F的水溶液均呈碱性,由C的饱和溶液制取F或E是重要的化工生产.回答下列问题:(1)写出下列物质的化学式:C
NaCl
NaCl
ENaHCO3
NaHCO3
(2)写出下列反应的化学方程式:B→D:
2Na202+2C02═2Na2CO3+02
2Na202+2C02═2Na2CO3+02
C→E:
NaCl+NH3+C02+H2O═NaHCO3↓+NH4Cl
NaCl+NH3+C02+H2O═NaHCO3↓+NH4Cl
(3)画出F的电子式:


(4)常温下若电解1L C的饱和溶液,当电路中通过0.1mol电子时,溶液的pH值(假设溶液体积不变)为
13
13
.分析:B为淡黄色粉末,应为Na202,常温下A为固体单质,应为Na,则G为02,I在常温下为液体,应为H2O,则F为NaOH,能与反应的除水之外还有C02,则J为C02,D为Na2CO3,E为NaHCO3,由C的饱和溶液制取F或E是重要的化工生产,则C为NaCl,C生成E的反应为侯氏制碱法的重要原理,K应为NH3,H为Cl2,以此解答该题.
解答:解:B为淡黄色粉末,应为Na202,常温下A为固体单质,应为Na,则G为02,I在常温下为液体,应为H2O,则F为NaOH,能与反应的除水之外还有C02,则J为C02,D为Na2CO3,E为NaHCO3,由C的饱和溶液制取F或E是重要的化工生产,则C为NaCl,C生成E的反应为侯氏制碱法的重要原理,K应为NH3,H为Cl2,
(1)由以上分析可知C为NaCl,E为NaHCO3,故答案为:NaCl;NaHCO3;
(2)J为C02,与Na202反应生成Na2CO3和02,反应的方程式为2Na202+2C02=2Na2CO3+02,C生成E的反应为侯氏制碱法的重要原理,反应的化学方程式为NaCl+NH3+C02+H2O=NaHCO3↓+NH4Cl,
故答案为:2Na202+2C02=2Na2CO3+02;NaCl+NH3+C02+H2O=NaHCO3↓+NH4Cl;
(3)F为NaOH,为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(4)电解饱和食盐水的方程式为2NaCl+2H2O
Cl2↑+H2↑+2NaOH,当电路中通过0.1mol电子时,生成NaOH0.1mol,则溶液的pH为13,故答案为:13.
(1)由以上分析可知C为NaCl,E为NaHCO3,故答案为:NaCl;NaHCO3;
(2)J为C02,与Na202反应生成Na2CO3和02,反应的方程式为2Na202+2C02=2Na2CO3+02,C生成E的反应为侯氏制碱法的重要原理,反应的化学方程式为NaCl+NH3+C02+H2O=NaHCO3↓+NH4Cl,
故答案为:2Na202+2C02=2Na2CO3+02;NaCl+NH3+C02+H2O=NaHCO3↓+NH4Cl;
(3)F为NaOH,为离子化合物,电子式为
 ,故答案为:
,故答案为: ;
;(4)电解饱和食盐水的方程式为2NaCl+2H2O
| ||
点评:本题以无机物的推断为载体综合考查物质的性质、电解原理以及化学用语等知识,题目难度中等,本题以过氧化钠的性质为突破口,答题时注意体会.

练习册系列答案
相关题目
 (本题有A、B两小题,考生任选一题解答,不得两题都解.若两题都解,则以A小题计分)
(本题有A、B两小题,考生任选一题解答,不得两题都解.若两题都解,则以A小题计分)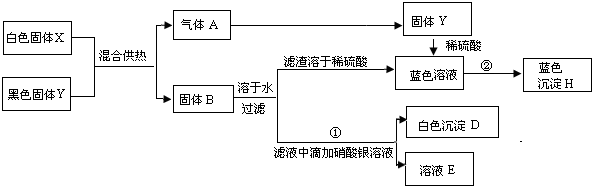
 A、B、C、D是中学化学中常见的四种物质,它们都含有一种相同的元素,其中A、D是固体,A是单质,B、C无色气体.它们的转化关系如图所示,请分析并填空:
A、B、C、D是中学化学中常见的四种物质,它们都含有一种相同的元素,其中A、D是固体,A是单质,B、C无色气体.它们的转化关系如图所示,请分析并填空: