题目内容
如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量为3.36g;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl).求:(1)100g该工业用食盐中含BaCl2的质量.
(2)请计算此工业用食盐中氯化钠的质量分数是多少?并判断该工业用食盐是否符合产品质量指标.

【答案】分析:(1)根据碳酸钠与氯化钡反应的化学方程式和生成沉淀的质量,列出比例式,就可计算出100g该工业盐中含氯化钡的物质的量;
(2)由标签可知,某工业盐产品主要含有氯化钠、水和氯化钡.根据已知水的质量分数计算出100g该工业盐中含H2O的质量,然后根据“100g-含H2O的质量-含BaCl2的质量=含NaCl的质量”计算出含NaCl的质量,然后根据质量分数公式计算即可.
解答:解:(1)设100g该工业用盐中含BaCl2的质量为x,
BaCl2+Na2CO3=BaCO3↓+2NaCl
208 197
x 0.985g
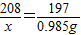
解之得x=1.04g;
(2)100g该工业盐中含H2O的质量为:100g×3.36%=3.36g;
100g该工业盐中含NaCl的质量为:100g-3.36g-1.04g=95.6g;
该工业盐中含NaCl的质量分数为: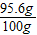 ×100%=95.6%;
×100%=95.6%;
因为95.6%>95.0%,所以该工业盐中氯化钠的质量分数符合产品质量指标.
答:(1)100g该工业盐中含氯化钡的质量为1.04g;
(2)此工业用食盐中氯化钠的质量分数是95.6%符合产品质量指标.
点评:本题主要考查学生运用化学方程式进行计算的能力.计算工业用盐中氯化钠的质量时,要注意减去工业用盐中所含有的少量的水的质量.
(2)由标签可知,某工业盐产品主要含有氯化钠、水和氯化钡.根据已知水的质量分数计算出100g该工业盐中含H2O的质量,然后根据“100g-含H2O的质量-含BaCl2的质量=含NaCl的质量”计算出含NaCl的质量,然后根据质量分数公式计算即可.
解答:解:(1)设100g该工业用盐中含BaCl2的质量为x,
BaCl2+Na2CO3=BaCO3↓+2NaCl
208 197
x 0.985g
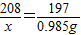
解之得x=1.04g;
(2)100g该工业盐中含H2O的质量为:100g×3.36%=3.36g;
100g该工业盐中含NaCl的质量为:100g-3.36g-1.04g=95.6g;
该工业盐中含NaCl的质量分数为:
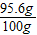 ×100%=95.6%;
×100%=95.6%;因为95.6%>95.0%,所以该工业盐中氯化钠的质量分数符合产品质量指标.
答:(1)100g该工业盐中含氯化钡的质量为1.04g;
(2)此工业用食盐中氯化钠的质量分数是95.6%符合产品质量指标.
点评:本题主要考查学生运用化学方程式进行计算的能力.计算工业用盐中氯化钠的质量时,要注意减去工业用盐中所含有的少量的水的质量.

练习册系列答案
相关题目
 (2013?同安区质检)如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量为3.36g;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl).
(2013?同安区质检)如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量为3.36g;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3=BaCO3↓+2NaCl). 如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3→BaCO3↓+2NaCl).
如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3→BaCO3↓+2NaCl).
 如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3→BaCO3↓+2NaCl).
如图是某工业用食盐产品质量指标.为了测定其中氯化钠的质量分数,取100g该工业用食盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀(化学方程式为:BaCl2+Na2CO3→BaCO3↓+2NaCl).