��Ŀ����
��ͼ��ij��ҵ��ʳ�β�Ʒ����ָ�꣮Ϊ�˲ⶨ�����Ȼ��Ƶ�����������ȡ100g�ù�ҵ��ʳ�ν���ʵ�飺�ٲ��ˮ������Ϊ3.36g������̼�������ⶨ�����Ȼ���������ʱ���õ�0.985g��������ѧ����ʽΪ��BaCl2+Na2CO3=BaCO3��+2NaCl����
��1��100g�ù�ҵ��ʳ���к�BaCl2��������
��2�������˹�ҵ��ʳ�����Ȼ��Ƶ����������Ƕ��٣����жϸù�ҵ��ʳ���Ƿ���ϲ�Ʒ����ָ�꣮

��1��1.04g ��2���˹�ҵ��ʳ�����Ȼ��Ƶ�����������95.6%���ϲ�Ʒ����ָ�꣮
��������
�����������1����100g�ù�ҵ�����к�BaCl2������Ϊx��
BaCl2+Na2CO3=BaCO3��+2NaCl
208 197
x 0.985g
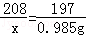
��֮��x=1.04g��
��2��100g�ù�ҵ���к�H2O������Ϊ��100g��3.36%=3.36g��
100g�ù�ҵ���к�NaCl������Ϊ��100g��3.36g��1.04g=95.6g��
�ù�ҵ���к�NaCl����������Ϊ��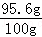 ��100%=95.6%��
��100%=95.6%��
��Ϊ95.6%��95.0%�����Ըù�ҵ�����Ȼ��Ƶ������������ϲ�Ʒ����ָ�꣮
�𣺣�1��100g�ù�ҵ���к��Ȼ���������Ϊ1.04g��
��2���˹�ҵ��ʳ�����Ȼ��Ƶ�����������95.6%���ϲ�Ʒ����ָ�꣮
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ���
������������Ҫ����ѧ�����û�ѧ����ʽ���м�������������㹤ҵ�������Ȼ��Ƶ�����ʱ��Ҫע���ȥ��ҵ�����������е�������ˮ��������

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д� ��2013?ͬ�����ʼ죩��ͼ��ij��ҵ��ʳ�β�Ʒ����ָ�꣮Ϊ�˲ⶨ�����Ȼ��Ƶ�����������ȡ100g�ù�ҵ��ʳ�ν���ʵ�飺�ٲ��ˮ������Ϊ3.36g������̼�������ⶨ�����Ȼ���������ʱ���õ�0.985g��������ѧ����ʽΪ��BaCl2+Na2CO3=BaCO3��+2NaCl����
��2013?ͬ�����ʼ죩��ͼ��ij��ҵ��ʳ�β�Ʒ����ָ�꣮Ϊ�˲ⶨ�����Ȼ��Ƶ�����������ȡ100g�ù�ҵ��ʳ�ν���ʵ�飺�ٲ��ˮ������Ϊ3.36g������̼�������ⶨ�����Ȼ���������ʱ���õ�0.985g��������ѧ����ʽΪ��BaCl2+Na2CO3=BaCO3��+2NaCl���� ��ͼ��ij��ҵ��ʳ�β�Ʒ����ָ�꣮Ϊ�˲ⶨ�����Ȼ��Ƶ�����������ȡ100g�ù�ҵ��ʳ�ν���ʵ�飺�ٲ��ˮ����������Ϊ3.36%������̼�������ⶨ�����Ȼ���������ʱ���õ�0.985g��������ѧ����ʽΪ��BaCl2+Na2CO3��BaCO3��+2NaCl����
��ͼ��ij��ҵ��ʳ�β�Ʒ����ָ�꣮Ϊ�˲ⶨ�����Ȼ��Ƶ�����������ȡ100g�ù�ҵ��ʳ�ν���ʵ�飺�ٲ��ˮ����������Ϊ3.36%������̼�������ⶨ�����Ȼ���������ʱ���õ�0.985g��������ѧ����ʽΪ��BaCl2+Na2CO3��BaCO3��+2NaCl���� ��ͼ��ij��ҵ��ʳ�β�Ʒ����ָ�꣮Ϊ�˲ⶨ�����Ȼ��Ƶ�����������ȡ100g�ù�ҵ��ʳ�ν���ʵ�飺�ٲ��ˮ����������Ϊ3.36%������̼�������ⶨ�����Ȼ���������ʱ���õ�0.985g��������ѧ����ʽΪ��BaCl2+Na2CO3��BaCO3��+2NaCl����
��ͼ��ij��ҵ��ʳ�β�Ʒ����ָ�꣮Ϊ�˲ⶨ�����Ȼ��Ƶ�����������ȡ100g�ù�ҵ��ʳ�ν���ʵ�飺�ٲ��ˮ����������Ϊ3.36%������̼�������ⶨ�����Ȼ���������ʱ���õ�0.985g��������ѧ����ʽΪ��BaCl2+Na2CO3��BaCO3��+2NaCl����