题目内容
【题目】氯化钙在生活中常用作干燥剂、融雪剂,在工业上可用于制造防冻液等。某工厂以石灰石为原料生产氯化钙晶体的流程如下:(原料石灰石中含的杂质主要是MgCO3、MgSO4 和Al2O3) 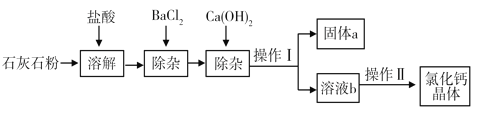
(1)石灰石粉溶解时,Al2O3发生反应的化学方程式为_____________________;
(2)加入BaCl2除杂的化学方程式为_____________________________;
(3)操作Ⅱ的具体步骤为___________________ 、冷却结晶;
(4)固体a的成分中含有的物质有_________________________________。
【答案】Al2O3 +6HCl==2AlCl3 +3H2O BaCl2+MgSO4 =BaSO4↓+MgCl2 蒸发浓缩 BaSO4、Mg(OH)2、Al(OH)3 (写两种即可得分)
【解析】
(1)石灰石粉溶解时,Al2O3与盐酸反应生成氯化铝和水,故填:Al2O3+6HCl═2AlCl3+3H2O;
(2)加入氯化钡能除去硫酸镁,故填:BaCl2+MgSO4 =BaSO4↓+MgCl2;
(3)操作Ⅱ是从溶液中得到氯化钙的晶体,需要蒸发水分,使溶液形成饱和溶液,然后析出晶体,故填:蒸发浓缩;
(4)得到的固体a中含有生成的硫酸钡沉淀、氢氧化镁沉淀和氢氧化铝沉淀,故填:BaSO4、Mg(OH)2、Al(OH)3。

【题目】某公司生产的新型融雪剂的成分是无水CaCl2和少量的氯化钠,为测定融雪剂中氯化钙的含量,化学兴趣小组的同学称取该样品12g,加水充分溶解,得到溶液50g,然后取一定质量分数的碳酸钠溶液100g平均分五次加入,充分振荡,实验数据见表。请你分析数据并进行有关计算。
次 数 | 1 | 2 | 3 | 4 | 5 |
加入碳酸钠溶液的质量/g | 20 | 20 | 20 | 20 | 20 |
生成沉淀的质量/g | 2.5 | x | 7.5 | 10 | 10 |
(1)上表中x的数值为_____。第_____次加入的碳酸钠与氯化钙恰好完全反应。
(2)样品中氯化钙的质量分数是多少_____?
(3)恰好完全反应时过滤,所得不饱和溶液的溶质质量分数是多少_____?
【题目】化学学科实践活动课上,老师拿来一包粉末。它是由长期放置在空气中的铁粉和久置的碱石灰干燥剂混合而成,让同学们设计实验进行探究。
(提出问题)固体样品的成分是什么?
(查阅资料)(1)碱石灰干燥剂是CaO和NaOH的混合物。
(2)BaCl2溶液显中性。
(猜想与假设)固体样品中可能含有 Fe、Fe2O3、CaO、NaOH、Ca(OH)2、Na2CO3和_____等七种物质。
(进行实验)
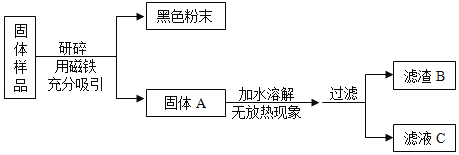
甲组同学对滤渣B的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论及化学方程式 |
取少量滤渣B于试管中,加入足量稀盐酸,将生成的气体通入澄清的石灰水中 | ①_____ ②_____ | 结论:滤渣B中有 Fe2O3,CaCO3.实验操作中反应的化学方程式为:_____(答出一个即可) |
乙组同学对滤液C的成分进行探究,记录如下:
实验操作 | 实验现象 | 实验结论 |
取少量滤液C于试管中,加入过量BaCl2溶液,静置,向上层清液中滴加无色酚酞试液,振荡 | ①有白色沉淀生成 ②酚酞试液由无色变成红色 | 滤液C中有_____ |
(解释与结论)(1)乙组同学实验中加入过量BaCl2溶液的目的是_____。
(2)通过以上实验探究,该固体样品中能确定一定含有的成分是_____。