题目内容
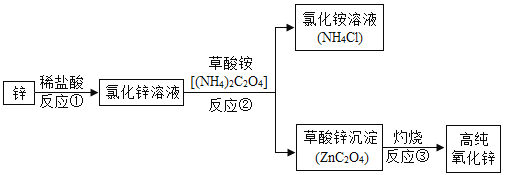
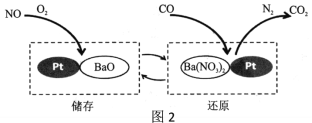
【题目】海水中含丰富的镁离子,工业上利用海水晒盐后剩下的母液(叫做苦卤水)生产氯化镁,并进一步制取单质镁。某活动小组设计如下流程,在实验室模拟利用苦卤水制取氯化镁。

下列说法不合理的是
A. 溶液X为盐酸
B. “沉淀”和“溶解”步骤发生的反应都属于复分解反应
C. “操作a”包括蒸发浓缩、过滤、洗涤、干燥
D. 工业生产中,“沉淀”步骤用生石灰代替氢氧化钠溶液,可降低成本
【答案】C
【解析】
A、盐酸与氢氧化镁反应生成氯化镁,所以溶液X为盐酸,选项正确,不符合题意;
B、“沉淀”是氯化镁与氢氧化钠反应生成氯化钠和氢氧化镁沉淀,“溶解”是稀盐酸与氢氧化镁反应生成氯化镁和水,两个反应均属于复分解反应,选项正确,不符合题意;
C、“操作a”应包括蒸发浓缩、蒸发结晶、过滤、干燥,结晶的晶体表面残留的盐酸在干燥过程中就能挥发掉,不需洗涤,选项错误,符合题意;
D、氧化钙与水反应生成氢氧化钙,氢氧化钙也能与氯化镁反应生成氢氧化镁,且生石灰的价格比氢氧化钠便宜得多,所以“沉淀”步骤可用生石灰代替氢氧化钠溶液,选项正确,不符合题意。故选C。

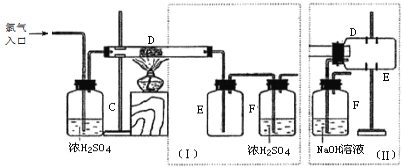
【题目】化学兴趣A组的同学们利用废硫酸液制备K2SO4,设计的流程如下图所示:
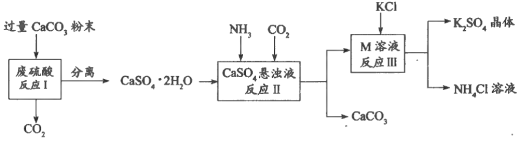
(1)写出反应Ⅰ的化学方程式:___________________________________________。
(2)反应Ⅱ生成了一种可用作氮肥的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_____________________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是___________________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是_____________;为了检验此晶体是否洗涤干净,常取最后一次洗涤液于试管中,先加入过量的_____________(选填字母),振荡、静置, 再向上层清液中滴加_____________(选填字母),观察现象即可判断该晶体是否洗涤干净。
A AgNO3溶液 B BaCl2溶液 C Ba(NO3)2溶液
D Ba(OH)2溶液 E NaOH溶液 F KOH溶液
【题目】小华将一张滤纸在某示剂中浸泡后晾干,用蘸有氢氧化钠溶液的玻璃棒在上面写“化学”两字,立刻显红色。再将其悬挂于铁架台上,并在滤纸的下方(如图)放置一个盛有某溶液的烧杯,过一会儿,发现红色的字消失,则滤纸上的指示剂和烧杯中的溶液分别是( )
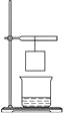
A | B | C | D | |
滤纸上的指示剂 | 酚酞溶液 | 酚酞溶液 | 石蕊溶液 | 石蕊溶液 |
烧杯中的溶液 | 浓氨水 | 浓盐酸 | 浓氨水 | 浓盐酸 |
A. A
B. B
C. C
D. D