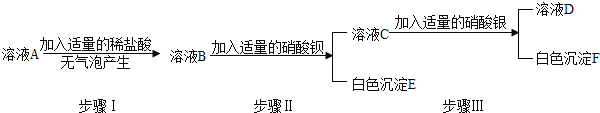
题目内容
【题目】减少有毒气体排放,变废为宝是保护大气环境的重要措施。
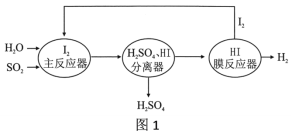
(1)工厂排出的尾气含SO2,可以通过图1工艺流程处理并获得氢气。
①写出主反应器中反应的化学方程式:__________
②膜反应器中化学变化的基本反应类型是___________________。
③该工艺流程中,能被循环利用的物质是______________。
(2)NSR技术通过BaO和Ba(NO3)2的相互转化实现NOx(如NO、NO2)的储存和还原,能降低柴油发动机NOx的排放。以NO为例,其工作原理如图2。
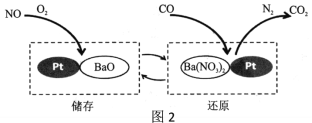
①储存时,部分NO和O2在一定条件下发生化合反应生成NO2,写出化学方程式:_________
②还原时,反应前后化合价发生变化的元素有_____________、____________。
【答案】2H2O + SO2+ I2 = H2SO4+ 2HI 分解反应 I2 2NO + O2![]() 2NO2 C N
2NO2 C N
【解析】
主反应器发生的反应为水和二氧化硫和碘单质反应生成硫酸和碘化氢,通过分离器,将硫酸和碘化氢分离,碘化氢在膜反应器中分解生成氢气和碘单质,部分NO和O2在一定条件下发生化合反应生成NO2。
(1)①主反应器中反应是水和二氧化硫和碘单质反应生成硫酸和碘化氢,化学方程式为![]() 。
。
②膜反应器中发生的反应是碘化氢分解生成氢气和碘单质,化学变化的基本反应类型是分解反应。
③碘化氢在膜反应器中分解生成氢气和碘单质,碘单质在主反应器又被循环利用,故该工艺流程中,能被循环利用的物质是![]() 。
。
(2)①储存时,部分NO和O2在一定条件下发生化合反应生成NO2,写出化学方程式:
 。
。
②还原时,一氧化碳生成二氧化碳,硝酸钡中的氮生成氮气,故反应前后化合价发生变化的元素有C、N。

【题目】图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示),下列说法正确的是( )
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |

A. 上述图象表示碳酸钠的溶解度曲线
B. 20℃时,氢氧化钠的溶解度大于碳酸钠
C. 40℃时,若将 50g NaOH 分别投入到 100g 水和 100g 酒精中,都能形成饱和溶液
D. 40℃时,将适量 CO2 通入饱和的 NaOH 酒精溶液中,观察不到明显的现象