题目内容
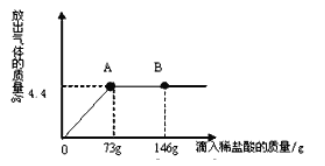
【题目】为了定量研究酸碱之间的反应。在一烧杯中盛有22.3g Na2CO3和NaCl组成的固体混合物,加50g水溶解,制成溶液。向烧杯中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的总质量与所滴入稀盐酸的质量关系曲线如图所示:
请根据题意回答问题:(H-1 Cl-35.5 Na-23 C-12 O-16)
①当滴加了73g稀盐酸时,放出气体的质量为 g。当滴加稀盐酸至图中B点时,烧杯中溶液里的溶质是 (写化学式)。
②当滴加了73g稀盐酸时(即A点时),烧杯中为不饱和溶液,试通过计算求出其中含溶质的质量分数(计算结果保留一位小数)。
【答案】
①4.4g;NaCl和HCl ②16.6%
【解析】
(1)根据曲线图像我们可以直接读出生成的气体质量为4.4g。在B点时,由于滴加的盐酸已经过量,所以,烧杯中除了溶质NaCl外还有盐酸的溶质HCl。
(2)根据曲线图像可以得知:
当滴加了73g稀盐酸时,参加反应的HCl质量为73g ![]() 10%=7.3g
10%=7.3g
解:设反应后生成NaCl的质量为x,混合物中Na2CO3的质量为y
Na2CO3 + 2HCl =2NaCl + H2O + CO2↑
106 117 44
y x 4.4g
![]()
![]()
x=11.7g y=10.6g
反应后溶质NaCl的质量分数:[11.7g+(22.3g-10.6g)]/(22.3g+50g+73g-4.4g)×100%=16.6%
知识点:酸碱化学性质、化学方程式计算。

练习册系列答案
相关题目