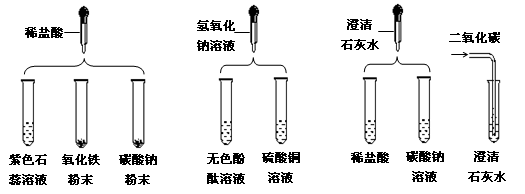
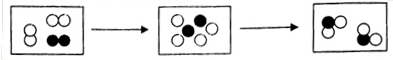
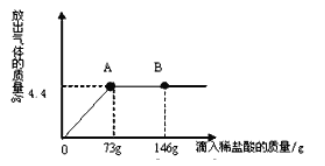
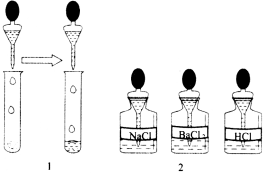
题目内容
【题目】化肥硝酸铵的化学式为(NH4NO3)。试求:
(1)硝酸铵中N、H、O三种元素的质量比;
(2)为了保证某一农作物获得3.5㎏氮元素,则需要硝酸铵多少㎏?
【答案】
(1)硝酸铵中N、H、O三种元素的质量比为:(14+14):(1×4):(16×3)
=28:4:48=7:1:12
(2)硝酸铵中氮元素的质量分数为:![]() =35%,
=35%,
为保证农作物获得3.5Kg氮元素,需要硝酸铵质量为:3.5kg÷35%=10kg
【解析】
(1):根据化学式,我们可以得知元素质量比为元素质量×原子个数之比。
即:酸铵中N、H、O三种元素的质量比为:(14+14):(1×4):(16×3)
=28:4:48=7:1:12
(2)根据题意,我们首先要计算出硝酸铵中氮元素的质量分数,然后再根据氮元素的质量÷硝酸铵中氮元素的质量分数=硝酸铵的质量计算出需要的硝酸铵的质量就可以了。
知识点:化肥量的计算。

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目