题目内容
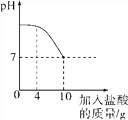
【题目】为探究氢氧化钙溶液和稀盐酸反应所得溶液中溶质的成分,小鸣和同学们通过测定反应后溶液的pH,得到了如图所示的pH曲线,请回答:

(1)由图可知该实验操作是将______________滴加到另一种溶液中。
(2)该反应的化学方程式为__________________________________________。
(3)实验过程中,小鸣取了a、b、c三处反应后的溶液于三个烧杯中,却忘了做标记,他设计不同的方案(不再用测定pH的方法),探究三种样品分别属于哪处溶液。
【查阅资料】CaCl2溶液显中性,CaCl2+Na2CO3===CaCO3↓+2NaCl。
【探究过程】
①分别取少量样品于三支试管中,加入酚酞试液,观察到其中一支试管内出现____________________________的现象。结论:该样品是a处溶液。
②为进一步确定b和c处溶液,又设计了以下方案:
实验步骤 | 实验现象 | 实验结论 |
另取余下样品少量于两支试管中,分别滴加足量的Na2CO3溶液 | ________________________ | 该样品为b处溶液 |
先有____________产生,后有________________产生 | 该样品为c处溶液,并推知溶液中的阳离子有________________ |
【反思评价】探究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑________________________________。
【答案】 稀盐酸 Ca(OH)2+2HCl===CaCl2+2H2O 溶液由无色变成红色 只产生白色沉淀 气泡 白色沉淀 Ca2+、H+ 反应物是否有剩余
【解析】 (1). 氢氧化钙溶液呈碱性,pH大于7,盐酸溶液呈酸性,溶液的pH小于7,因此由图中信息可知,实验是将稀盐酸加入氢氧化钙中; (2).氢氧化钙和盐酸反应生成氯化钙和水,反应方程式为: Ca(OH)2+2HCl===CaCl2+2H2O ; (3). A点溶质为:氢氧化钙、氯化钙,溶液呈碱性;b点刚好完全反应,溶质为氯化钙,溶液呈中性;c点酸过量,溶质为:氯化钙、氯化氢,溶液呈酸性;只有a点溶液能使酚酞溶液由无色变成红色 ;(4). B点溶溶中加入碳酸钠只发生碳酸钠和氯化钙反应生成碳酸钙沉淀和和氯化钠,只产生白色沉淀; (5).c点溶液中加入碳酸钠溶液,先发生碳酸钠与盐酸反应生成二氧化碳、氯化钠、水,而产生气泡 ; 后碳酸钠与氯化钙反应生成碳酸钙沉淀和和氯化钠,现象为:生成白色沉淀;(7). C点氯化氢和氯化钙溶于水产生的阳离子为:Ca2+、H+ ; (8). 究反应后溶液中溶质的成分,除了要考虑生成物之外,还要考虑反应物是否有剩余。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】(1)通过实验,我们测得了石灰水、碳酸饮料、食醋及食盐水的pH,图中箭头方向表示pH逐渐增大,则表示石灰水的是点________,表示食盐水的是点________。(均填字母)
![]()
(2)不同物质的溶液的酸碱性不同,根据下表中pH的情况判断:
物质 | 盐酸 | CuSO4溶液 | NaCl | 水 | Na2CO3溶液 | NaOH溶液 |
pH | <7 | <7 | =7 | =7 | >7 | >7 |
①Na2CO3溶液加入无色酚酞试液,试液变________色;
②pH<7的溶液________(选填“一定”或“不一定”)是酸溶液。
(3)甲酸(HCOOH)是一种有机酸,它的酸性比碳酸强,比盐酸弱,有刺激性气味和较强的腐蚀性。蚂蚁、蚊虫叮咬时会分泌出甲酸,所以甲酸又俗称蚁酸。人被蚊虫叮咬后会痛痒,可以涂抹下列物质中的________(填字母,下同)消除。
A.稀盐酸 B.食醋 C.肥皂水 D.食盐水 E.稀氨水
(4)白蚁除了会蛀蚀木头外,它分泌的蚁酸还会腐蚀很多建筑材料,下列建筑材料不容易被蚁酸腐蚀的是________。
A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗 E.钢筋