题目内容
某化学活动小组用稀盐酸对赤铁矿Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液.为防止直接排放造成环境污染,对其组成进一步进行探究.过滤该残液,取100g 滤液,向其中不断加入5%的氢氧化钠溶液,所得实验数据如下表:
| 加入氢氧化钠的溶液的质量/g | 20 | 40 | 60 | 80 | 160 | 180 |
| 生成沉淀的质量/g | 0 | 0 | 0.80 | 1.78 | 5.35 | 5.35 |
(2)选择合理的数据,计算100g 滤液中溶质的质量(若有多种溶质,任选一种.结果精确到0.01g).
可能用到的相对原子质量:H-1 O-16 Na-23 Cl-35.5 Fe-56.
解:
(1)从表格数据中可看出向滤液中加入氢氧化钠溶液,开始没有沉淀,说明滤液中有盐酸,再加入氢氧化钠溶液有沉淀生成,说明有氯化铁存在.
故答案为:HCl FeCl3
(2)解一:
解:从数据可看出当加入氢氧化钠溶液的质量从60g到80g,生成沉淀0.98g,即20g氢氧化钠溶液和氯化铁溶液反应生成沉淀0.98g;
那么生成0.8g沉淀所消耗氢氧化钠溶液的质量为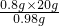 =16.3g,
=16.3g,
所以当加入氢氧化钠溶液的质量从40g到60g时,和盐酸反应的氢氧化钠溶液的质量为20g-16.3g=3.7g
即滤液中盐酸共反应的氢氧化钠溶液的质量为40g+3.7g=43.7g
进而求出滤液中盐酸的质量;
设滤液中HCl 的质量为x.
NaOH+HCl═NaCl+H2O
40 36.5
43.7g×5% x
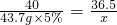
解之得:X=1.99g
答:100g 滤液中溶质HCl的质量为1.99克.
解二:
解:设滤液中FeCl3 的质量为y.
3NaOH+FeCl3═3NaCl+Fe(OH)3↓
162.5 107
Y 5.35 g
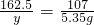
解之得:Y≈8.13
答:100g 滤液中溶质FeCl3的质量为8.13克.
分析:首先要分析数据的变化,找出参加反应的氢氧化钠和盐酸及氯化铁的关系.从数据可看出当加入氢氧化钠溶液的质量从60g到80g,生成沉淀0.98g,可求出生成0.8g沉淀所消耗氢氧化钠溶液的质量,进而求出滤液中盐酸的质量;
在分析沉淀的质量可知生成沉淀的最大质量为5.35g,可根据沉淀的质量求出滤液中氯化铁的质量.
点评:解答本题的关键是要认真分析数据变化与反应的关系,当加入40g氢氧化钠溶液时,滤液中的盐酸并没有完全反应,因为从表格数据可发现当加入氢氧化钠溶液的质量从40g到60g时,生成沉淀0.8g,而当加入氢氧化钠溶液的质量从60g到80g,生成沉淀0.98g,质量大于0.8g.
(1)从表格数据中可看出向滤液中加入氢氧化钠溶液,开始没有沉淀,说明滤液中有盐酸,再加入氢氧化钠溶液有沉淀生成,说明有氯化铁存在.
故答案为:HCl FeCl3
(2)解一:
解:从数据可看出当加入氢氧化钠溶液的质量从60g到80g,生成沉淀0.98g,即20g氢氧化钠溶液和氯化铁溶液反应生成沉淀0.98g;
那么生成0.8g沉淀所消耗氢氧化钠溶液的质量为
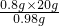 =16.3g,
=16.3g,所以当加入氢氧化钠溶液的质量从40g到60g时,和盐酸反应的氢氧化钠溶液的质量为20g-16.3g=3.7g
即滤液中盐酸共反应的氢氧化钠溶液的质量为40g+3.7g=43.7g
进而求出滤液中盐酸的质量;
设滤液中HCl 的质量为x.
NaOH+HCl═NaCl+H2O
40 36.5
43.7g×5% x
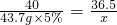
解之得:X=1.99g
答:100g 滤液中溶质HCl的质量为1.99克.
解二:
解:设滤液中FeCl3 的质量为y.
3NaOH+FeCl3═3NaCl+Fe(OH)3↓
162.5 107
Y 5.35 g
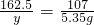
解之得:Y≈8.13
答:100g 滤液中溶质FeCl3的质量为8.13克.
分析:首先要分析数据的变化,找出参加反应的氢氧化钠和盐酸及氯化铁的关系.从数据可看出当加入氢氧化钠溶液的质量从60g到80g,生成沉淀0.98g,可求出生成0.8g沉淀所消耗氢氧化钠溶液的质量,进而求出滤液中盐酸的质量;
在分析沉淀的质量可知生成沉淀的最大质量为5.35g,可根据沉淀的质量求出滤液中氯化铁的质量.
点评:解答本题的关键是要认真分析数据变化与反应的关系,当加入40g氢氧化钠溶液时,滤液中的盐酸并没有完全反应,因为从表格数据可发现当加入氢氧化钠溶液的质量从40g到60g时,生成沉淀0.8g,而当加入氢氧化钠溶液的质量从60g到80g,生成沉淀0.98g,质量大于0.8g.

练习册系列答案
相关题目