题目内容
【题目】元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息:
(1)画出硫原子结构示意图为 _________,在化学反应中易_________电子(选填“得到”或“失去”),形成_________(填粒子符号)。
(2)在第二周期中,各原子结构的共同之处是_________。
(3)9号元素与17号元素化学性质相似的原因是_________。
(4)13号元素铝的相对原子质量为27,其原子核内除有13个质子外还有_________。
(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质。下列各组粒子中属于等电子体的是_________(填字母序号)。
A. NO和O2 B.CO和 N2 C. SO2和 CO2 D. PO43-和SO42-
【答案】 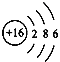 得到 S2- 电子层数相同 最外层电子数相同 14个中子(缺个数、中子之一,不得分) BD(漏1个,不得分)
得到 S2- 电子层数相同 最外层电子数相同 14个中子(缺个数、中子之一,不得分) BD(漏1个,不得分)
【解析】根据原子核外电子排布规律可知,最外层电子数多于4,一般容易得到电子,形成阴离子;元素的化学性质主要取决于最外层电子数,如果最外层电子束相同,元素的化学性质就相似,所以同一族元素化学性质相似;原子核由质子和中子构成,质子带正电,中子不带电;具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质。(1)硫原子中质子数等于电子数为16,所以硫原子结构示意图为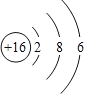 ;在化学反应中易得到2个电子,形成硫离子,符号为
;在化学反应中易得到2个电子,形成硫离子,符号为![]() ;(2)根据元素周期表的排列规律可知,同一周期电子层数相同;(3)9号元素是氟元素,17号元素是氯元素,最外层电子数都为7,所以化学性质相似;(4) 3号元素铝的相对原子质量为27,其原子核内除有13个质子外还有14个中子;(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质,因此所给各组中各组粒子中属于等电子体的是BD。
;(2)根据元素周期表的排列规律可知,同一周期电子层数相同;(3)9号元素是氟元素,17号元素是氯元素,最外层电子数都为7,所以化学性质相似;(4) 3号元素铝的相对原子质量为27,其原子核内除有13个质子外还有14个中子;(5)具有相同原子数和电子数的分子或离子叫等电子体,等电子体具有相似的微粒结构和性质,因此所给各组中各组粒子中属于等电子体的是BD。

【题目】在H、C、O、N四种元素中,选择一种或若干种用化学式填写下列空格:
(1)可用于灭火的气体 ;(2)相对分子质量最小的氧化物 ;
(3)一种可再生的液体燃料 ;(4)能支持动植物呼吸的一种单质 .
【题目】定量研究对于化学科学发展有重大作用,因此我们应该掌握好有关质量守恒定律的相关知识。
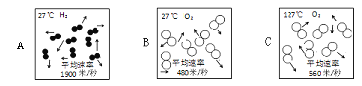
(1)在验证质量守恒定律时,下列A、B、C三个实验设计中,不能达到实验目的的是______(选填序号),理由是_______________。
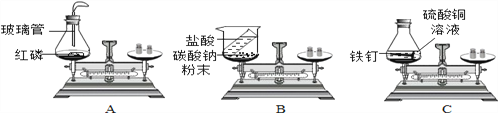
(2)从微观角度分析,解释反应中,质量守恒定律成立的原因是:_____。
(3)在一个密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表:
物质 | A | B | C | D |
反应前质量/g | 2 | 24.5 | 4 | 8 |
反应后质量/g | 16.9 | 0 | 13.6 | X |
表中X=______,该反应中D物质可能起了_________作用。容器内发生的反应的基本类型是_________。