题目内容
【题目】淀粉等食用糖类在人体能转化为葡萄糖(C6H12O6)而被吸收,正常人的血液里约含0.1%的葡萄糖。
(1)一个葡萄糖分子中共有_____原子;
(2)葡萄糖中碳元素和氢元素的质量比为_____;
(3)葡萄糖中氧元素的质量分数为_____;(要求写出计算过程,计算结果精确到0.1%)
(4)多少克葡萄糖中含氧元素的质量为10克?(写过程,保留整数)_____。
【答案】24 6:1 53.3% 19g
【解析】
(1)根据葡萄糖(C6H12O6)化学式可知,一个葡萄糖分子中共有6+12+6=24个原子;
(2)葡萄糖中碳元素和氢元素的质量比=(12×6):(1×12)=6:1;
(3)葡萄糖中氧元素的质量分数为![]() ;
;
(4)含氧元素的质量为10克的葡萄糖的质量为10g÷53.3%≈19g。

【题目】碳酸钠在实际生产、生活中有着广泛的用途,如制造玻璃、造纸和纺织等。
(1)碳酸钠俗称苏打或____。如图为侯氏制碱法的流程图,通过步骤I后得到的悬浊液中有小苏打(在该溶液中难溶)和一种氮肥,请写出步骤I中发生反应的化学方程式:_____;上述过程中得到的氮肥遇碱会生成具有刺激性气味的______(填化学式),该气体能使_____;从流程图中可得出小苏打的一条化学性质是_____。
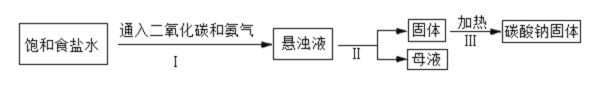
(2)氢氧化钠在空气中容易变质生成碳酸钠,现有放在空气中一段时间的氢氧化钠溶液,其中溶质的成分可能是:猜想①:NaOH;猜想②:Na2CO3;猜想③:_____。请设计实验证明猜想③正确。(写出相关的步骤和现象)________
(3)某海洋化工集团生产的碳酸钠产品中含有少量氯化钠杂质,其产品包装袋上标明:碳酸钠≥96%。为测定该产品中碳酸钠的质量分数,现取11.0g碳酸钠样品放入烧杯中,称得烧杯及所盛碳酸钠样品的总质量为158.0g,然后向烧杯中加入100g稀盐酸,充分反应,实验数据记录如下:
反应时间/min | 3 | 6 | 9 | 12 |
烧杯及所盛物质的总质量/g | 255.8 | 254.0 | 253.6 | 253.6 |
请你据此分析计算,该产品中碳酸钠的质量分数_____(是、否)符合标准。(写出计算过程,结果精确到0.1%)