题目内容
【题目】如图是两个实验装置(铁架台等辅助仪器略去未画)
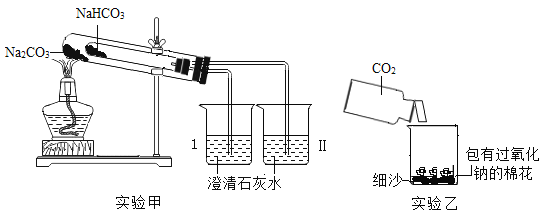
(1)实验甲用来比较碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的热稳定性。加热一段时间 后 I 烧杯中产生气泡,澄清石灰水不变浑浊;Ⅱ烧杯中产生气泡,澄清石灰水先变浑浊后变澄清;小试管口有水珠,取小试管内剩余固体检验成分与大试管内固体相同。则
①Ι烧杯中产生气泡的原因是________;
②Ⅱ烧杯中澄清石灰水先变浑浊的反应方程式为_________________;后变 澄清的反应方程式为CaCO3 CO2H2OCa(HCO3)2
③写 出 Na2CO3和 NaHCO3固 体 中 热 稳 定 性 较 差 的 物 质 的 分 解 反 应 方 程 式为_____________;
④已知 NaHCO3NaOHNa2CO3H2O,则鉴别 Na2CO3和 NaHCO3两种溶液时可取其中一种溶液加入(填编号)___________________中,若看到___________现象产生,则该物质为 Na2CO3。
A 稀盐酸 B 澄清石灰水 C NaOH 溶液 D CaCl2 溶液
(2)实验乙用来验证 Na2O2 与CO2的反应,观察到的实验现象是:包有 Na2O2 的棉花着火燃烧。
①实验室制CO2反应方程式为_________________________________;
②此实验验证了CO2的一个物理性质是__________________;
③棉花燃烧说明该反应的特点是(从能量角度)_________________;
④反应生成物有 Na2CO3 和O2,则该反应方程式为____________________;
【答案】温度升高,体积膨胀,导管口会冒出气泡 ![]()
![]() D 溶液变浑浊
D 溶液变浑浊 ![]() 密度大于空气的密度 反应放热
密度大于空气的密度 反应放热 ![]()
【解析】
实验一,比较碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)的热稳定性,在同一温度下加热,根据现象不同进行分析,对于两种的溶液进行鉴别,就是对![]() 和
和![]() 进行鉴别,因此需要用到
进行鉴别,因此需要用到![]() ,但是碳酸氢钠与碱反应后会生成
,但是碳酸氢钠与碱反应后会生成![]() ,因此不能用
,因此不能用![]() 鉴别;实验二,验证 Na2O2 与CO2的反应,倒入CO2可知碳他的密度大于空气的密度,棉花燃烧可知反应是放热反应。
鉴别;实验二,验证 Na2O2 与CO2的反应,倒入CO2可知碳他的密度大于空气的密度,棉花燃烧可知反应是放热反应。
(1)①澄清石灰水未变浑浊,没有![]() 生成,但是试管内温度升高,空气的体积会膨胀变大,导管口会有气泡冒出,故原因是温度升高,体积膨胀,导管口会冒出气泡;
生成,但是试管内温度升高,空气的体积会膨胀变大,导管口会有气泡冒出,故原因是温度升高,体积膨胀,导管口会冒出气泡;
②澄清石灰水的主要成分为![]() ,会与
,会与![]() 发生反应生成的
发生反应生成的![]() 难溶于水,所以溶液会变浑浊,故反应化学方程式为
难溶于水,所以溶液会变浑浊,故反应化学方程式为![]() ;
;
③试管口有水珠,生成了![]() ,澄清石灰水变浑浊,生成了
,澄清石灰水变浑浊,生成了![]() ,小试管内剩余固体检验成分与大试管内固体相同,可知生成了
,小试管内剩余固体检验成分与大试管内固体相同,可知生成了![]() ,故分解反应的化学方程式为
,故分解反应的化学方程式为![]() ;
;
④鉴别![]() 和
和![]() 的溶液,就是对
的溶液,就是对![]() 和
和![]() 进行鉴别,因此可以用
进行鉴别,因此可以用![]() ,但是NaHCO3NaOHNa2CO3H2O,即
,但是NaHCO3NaOHNa2CO3H2O,即![]() 能与
能与![]() 溶液发生反应,又生成
溶液发生反应,又生成![]() ,因此不能用
,因此不能用![]() 鉴别,故选D,鉴别反应会生成白色
鉴别,故选D,鉴别反应会生成白色![]() 沉淀,故现象为溶液变浑浊;
沉淀,故现象为溶液变浑浊;
(2)①实验室用大理石与稀盐酸反应,大理石的主要成分![]() ,故化学方程式为
,故化学方程式为![]() ;
;
②![]() 气体是用倾倒的方法进行的添加,故
气体是用倾倒的方法进行的添加,故![]() 的密度大于空气的密度;
的密度大于空气的密度;
③棉花是可燃物,同时与空气接触,根据燃烧的三个条件,可知需要温度达到着火点,故反应放热;
④反应物有![]() 和
和![]() ,生成物有
,生成物有![]() 和
和![]() ,在常温下进行了反应,故反应的化学方程式为
,在常温下进行了反应,故反应的化学方程式为![]()

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案