题目内容
【题目】碳还原氧化铜的实验装置。某化学小组对该实验及产物的探究如下: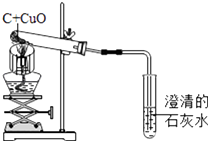
(1)写出该反应的化学方程式。
(2)酒精灯加网罩的目的是。
(3)刚开始加热时,澄清石灰水中有气泡冒出,但澄清石灰水不变浑独,原因是。
(4)实验结束应先_________。(选填答案序号)
A.撤离酒精灯
B.将导管移出石灰水.
C.拨掉橡胶塞
(5)【探究一】检验产物成分
【提出问题】:实验产物是暗红色固体,很难观察到紫红色固体,暗红色固体是什么?
【查阅资料】:氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4 =CuSO4 +Cu + H2O。
【猜想与假设】:暗红色固体除铜外还可能含有Cu2O
【设计实验】
操作:取少量暗红色固体,加入稀硫酸,观察到现象:、。结论:暗红色固体含有Cu2O。
(6)【探究二】测定产物中Cu2O的含量
为测定红色固体中氧化亚铜的质量分数,小组同学设计了如下两种方案:
甲方案:甲同学称取10g红色固体加人到足量稀硫酸中使其充分反应后,过滤(填操作名称)、干燥、称量剩余红色固体的质量为8 g,则红色固体中氧化亚铜的质量分数为。
乙方案:实验原理:Cu2O +H2 ![]() 2Cu +H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略,碱石灰为氧化钙和氢氧化钠的混合物,通过测定反应前后装置d的质量达到实验目的。
2Cu +H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略,碱石灰为氧化钙和氢氧化钠的混合物,通过测定反应前后装置d的质量达到实验目的。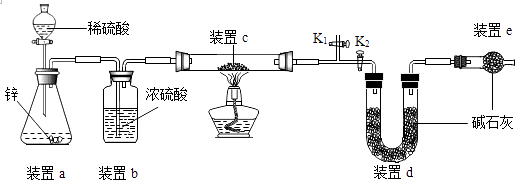
(7)装置a中用稀硫酸而不用稀盐酸,原因是;
(8)若不加装置c,实验结果会偏(“大”或“小”),原因是;
(9)点燃酒精灯前涉及的部分操作如下,正确的顺序是;
①打开K2,关闭K1 ②检查装置的气密性 ③连接仪器 ④关闭K2 , 打开K1 , 通氢气一段时间
(10)【拓展反思]】:
还可通过测定反应前后装置(填“a”、“b”、“c”)的质量达到测定产物中Cu2O的含量目的。
(11)乙方案第(9)的④中“通氢气一段时间”的目的是排出装置内的空气,否则可能带来哪些影响?、(答出两点)
【答案】
(1)2CuO +C ![]() 2Cu +CO2↑
2Cu +CO2↑
(2)聚集火焰,提高温度
(3)此时逸出的气体是试管内的空气,而非二氧化碳
(4)B
(5)溶液变为蓝色;生成紫红色固体
(6)洗涤;36%
(7)盐酸挥发出HCl气体,与d中的物质反应,影响测定结果
(8)偏大;装置d会吸收空气中的水蒸气和二氧化碳,使测定生成水的质量偏大,导致计算出的Cu2O质量偏大
(9)③②④①
(10)c
(11)氢气不纯;点燃时发生爆炸
【解析】(1)化学方程式表示为:2CuO +C ![]() 2Cu +CO2↑;(2)目的是聚集火焰,提高温度;(3)开始的气体是试管内的空气,而非二氧化碳;(4)实验结束应先将导管移出石灰水再熄灭酒精灯;
2Cu +CO2↑;(2)目的是聚集火焰,提高温度;(3)开始的气体是试管内的空气,而非二氧化碳;(4)实验结束应先将导管移出石灰水再熄灭酒精灯;
【探究一】(5)现象为溶液由无色变成蓝色、生成紫红色固体,说明暗红色固体含有Cu2O;
【探究二】(6)洗涤;红色固体中氧化亚铜的质量分数为 36%;
(7)盐酸挥发出HCl气体,与d中的物质反应,影响测定结果;
(8)d中的碱石灰会吸收空气中二氧化碳和水,从而使测定的水的质量偏高,会导致计算的氧化亚铜的质量偏高,从而导致实验结果偏高;
(9)顺序是③②④①;
(10)还可通过测定反应前后装置c的质量达到实验目的;
(11)氢气不纯,点燃时发生爆炸。
(1)碳还原氧化铜生成的是铜和二氧化碳,反应的化学方程式表示为:2CuO +C ![]() 2Cu +CO2↑;
2Cu +CO2↑;
(2)酒精灯加网罩的目的是聚集火焰,提高温度;
(3)刚开始加热时试管中的空气膨胀排出试管,即开始的气体是试管内的空气,而非二氧化碳,故澄清石灰水不变浑浊;
(4)实验结束应先将导管移出石灰水再熄灭酒精灯,目的是防止澄清石灰水倒流入试管中使试管炸裂;
(5)根据资料可知Cu2O能与稀硫酸反应生成蓝色的硫酸铜,而铜不能,故溶液由无色变成蓝色、生成紫红色固体,说明暗红色固体含有Cu2O;
(6)由于铜上面可能会沾有一些其他的物质,故要将过滤后的铜进行洗涤;设红色固体中铜的质量为x,那么Cu2O的质量为10g-x,生成的铜质量为8g-x。利用化学方程式即可计算出铜的质量;
Cu2O+H2SO4 =CuSO4 + | Cu + H2O |
144 | 64 |
10g-x | 8g-x |
![]() x=6.4g
x=6.4g
氧化亚铜的质量分数= ![]() 36%,红色固体中氧化亚铜的质量分数为 36%;
36%,红色固体中氧化亚铜的质量分数为 36%;
(7)盐酸具有挥发性,挥发出HCl气体能被碱石灰吸收,影响测定结果,故不用稀盐酸;
(8)若不加装置e,那么d中的碱石灰会吸收空气中二氧化碳和水,从而使测定的水的质量偏高,会导致计算的氧化亚铜的质量偏高,从而导致实验结果偏高;
(9)点燃酒精灯要连接好仪器,检查装置的气密性,关闭K2 , 打开K1 , 通氢气一段时间把装置中的水蒸气和二氧化碳排出,再打开K2,关闭K1 , 点燃酒精灯,故顺序是③②④①;
(10)还可通过测定反应前后装置c的质量达到实验目的,反应前后装置c的质量差即为氧化亚铜中氧元素的质量,根据氧元素的质量可算出氧化亚铜的质量,进一步计算出产物中氧化亚铜的质量;
(11)若没有通氢气一段时间,那么氢气就不纯,氢气不纯可能会发生爆炸,故要先通氢气一段时间。

 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案