题目内容
【题目】下列家庭小实验可行的是
A.用水擦拭衣服上的油渍
B.用白酒除去热水瓶中的水垢
C.用纱布过滤将硬水转化成软水
D.用灼烧的方法区别羊毛线和棉线
【答案】D
【解析】
A、油渍不溶于水,故无法用水擦拭衣服上的油渍,实验不可行。
B、热水瓶中的水垢主要成分是碳酸钙,和白酒不反应,故无法用白酒除去热水瓶中的水垢,实验不可行。
C、硬水是含较多可溶性钙镁矿物质的水,过滤无法去除可溶性物质,故无法用纱布过滤将硬水转化成软水,实验不可行。
D、羊毛线燃烧有烧焦羽毛味,棉线燃烧有烧纸味,故可用灼烧的方法区别羊毛线和棉线,实验可行。
故选:D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】质量守恒定律的发现对化学的发展做出了重要的贡献。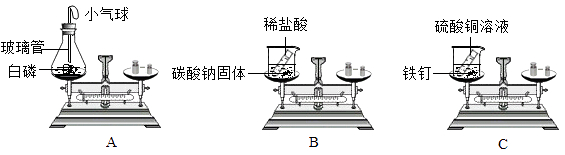
(1)如图所示的3个实验验证质量守恒定律,其中实验前后天平不能保持平衡的是(填序号),理由是
(2)从微观角度分析有助于我们理解质量守恒定律.在一密闭容器内有4种物质A,B,C,D,它们在一定条件下发生化学反应.经过一段时间后停止反应,其中A,B,C,D的微观示意图和反应前后各物质的质量如下表所示.
物质 | A | B | C | D |
|
微观示意图 |
|
|
|
| |
反应前质量/g | 100 | 20 | x | 206 | |
反应后质量/g | 32 | 140 | 126 | 46 |
(Ⅰ)从微观角度分析,化学反应中质量守恒的原因是 .
(Ⅱ)B的化学式为 .
(Ⅲ)该反应中B和C的质量比为 .
(Ⅳ)表中x的值是 .