题目内容
【题目】人类社会的发展离不开金属。请依据所学知识填空。
(1)下列制品的用途,利用金属导热性的是________。

(2)金属资源在地球上分布广泛。人们在自然界中仅发现金、银等少数金属单质,其余金属元素都以化合物形式存在。你认为金属的存在形式主要和________有关。
(3)农业上用硫酸铜、生石灰加水配制波尔多液作为杀菌剂,不用铁质容器来配制或盛放波尔多液,写出反应的化学方程式_____________;反应类型:___________。工业上常用稀盐酸除铁锈(Fe2O3),该反应的化学方程式是__________;反应类型:__________。
【答案】A 金属活动性强弱 Fe+CuSO4=Cu+FeSO4 置换反应 6HCl+Fe2O 3=2FeCl3+3 H2O 复分解反应
【解析】
解:(1)铁锅利用了铁的导热性,铜导线利用了铜的导电性,钢丝绳利用了钢的延展性,黄金饰品利用了金的金属光泽;
(2)金属的存在形式主要和金属活动性强弱有关;
(3)铁和硫酸铜反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4,该反应由一种单质和一种化合物反应生成了另一种单质和另一种化合物,属于置换反应;工业上常用稀盐酸除铁锈(Fe2O3),该反应的化学方程式是:6HCl+Fe2O 3=2FeCl3+3 H2O;该反应是两种化合物相互交换成分生成了两种新的化合物,反应类型为复分解反应。

 文敬图书课时先锋系列答案
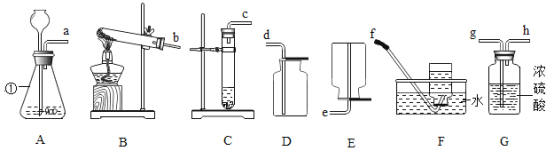
文敬图书课时先锋系列答案【题目】氯化铁(FeCl3)溶液能对过氧化氢的分解起催化作用,某小组拟在相同浓度氯化铁溶液的催化下,探究氯化铁对不同浓度过氧化氢溶液分解速率的影响。(资料:氯化铁溶液是氯化铁FeCl3和水的混合物,过氧化氢溶液是过氧化氢和水的混合物)
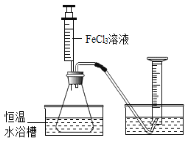
(1)分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的氯化铁溶液,如图所示,通过观察_______________可以粗略判断过氧化氢的分解速率,从而得出实验结果。
写出过氧化氢在氯化铁做催化剂时发生反应的文字表达式__________________。
(2)为进一步判断上述实验结论的准确性,小刚同学进行了如下实验方案设计:
[方案一] 在不同过氧化氢浓度下,测定收集相同气体所需时间。
[方案二] 在不同过氧化氢浓度下,测定____________________。
方案二的实验测量结果
过氧化氢溶液的浓度和体积 | 2%氯化铁溶液的体积(mL) | 反应的时间(min) | 生成O2的体积(mL) | |
实验1 | 8%10 mL | X | 5 | V1 |
实验2 | 16%10 mL | 3 | Y | V2 |
表中X=____________,Y=_____________。
实验结论:通过测量V1小于V2 ,说明_______________________。