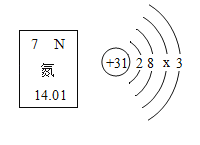
题目内容
【题目】质量守恒定律的发现对化学的发展做出了重要贡献。
(1)某同学用图1所示的装置验证质量守恒定律时,将锥形瓶倾斜,使稀盐酸与大理石接触,反应方程式是_____。 待充分反应后,发现天平指针指向_____(填“a方向”、 “b方向”或“O”),实验中气球的作用:①使装置密闭,②_____;
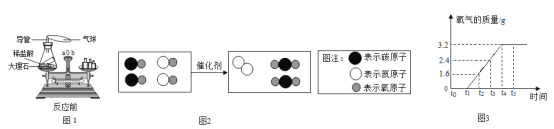
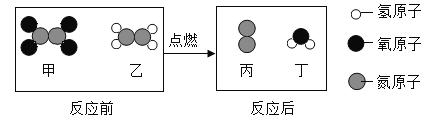
(2)某化学反应微观过程如图2所示,该反应的化学方程式为_____;反应前后不改变的是_____;
①原子种类 ②分 子种类 ③物质质量 ④元素种类 ⑤分子个数
(3)加热一定量的高锰酸钾固体,生成的氧气质量如图3所示。从反应条件分析,在t1前没有氧气生成的原因是_____。写出高锰酸钾分解制氧气的化学方程式_____。 该 反应的理论产氧率为_____。[![]() ,结果精确到0.1%]。 而实际产氧率远高于上述数值,则可能的原因有_____ ( 测定过程中产生的误差可忽略)。
,结果精确到0.1%]。 而实际产氧率远高于上述数值,则可能的原因有_____ ( 测定过程中产生的误差可忽略)。
【答案】CaCO3+2HCl=CaCl2+H2O+CO2↑ b 缓冲气体压强 2NO+2CO N2+2CO2 ①③④ 温度太低,高猛酸钾未分解 2KMnO4
N2+2CO2 ①③④ 温度太低,高猛酸钾未分解 2KMnO4![]() K2MnO4+MnO2+O2↑ 10.1% 锰酸钾加热时可能产生氧气
K2MnO4+MnO2+O2↑ 10.1% 锰酸钾加热时可能产生氧气
【解析】
(1)某同学用图1所示的装置验证质量守恒定律时,将锥形瓶倾斜,使稀盐酸与大理石接触,反应方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑。 该反应符合质量守恒定律,待充分反应后,发现天平指针指向b,反应产生二氧化碳,气体膨胀会产生空气浮力,左边质量减轻;实验中气球的作用:①使装置密闭,②缓冲气体压强;
(2)某化学反应微观过程如图2所示,该反应的化学方程式为:2NO+2CO N2+2CO2;该反应符合质量守恒定律,反应前后不改变的是:
N2+2CO2;该反应符合质量守恒定律,反应前后不改变的是:
①原子种类,不会改变;
②分子种类,会改变;
③物质质量,不会改变;
④元素种类,不会改变;
⑤分子个数,会改变;
故选:①③④;
(3)加热一定量的高锰酸钾固体,生成的氧气质量如图3所示。从反应条件分析,在t1前没有氧气生成的原因是温度太低,高猛酸钾未分解;。写出高锰酸钾分解制氧气的化学方程式:2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
根据化学方程式,该反应的理论产氧率为=![]() 。 而实际产氧率远高于上述数值,则可能的原因有:锰酸钾加热时可能产生氧气.
。 而实际产氧率远高于上述数值,则可能的原因有:锰酸钾加热时可能产生氧气.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn) ,它可用来制造电器零件及日用品。为了测定某黄铜样品中铜的质量分数(不考虑黄铜中的其他杂质),兴趣小组同学设计了下列两个实验分别测定H2的质量和体积。
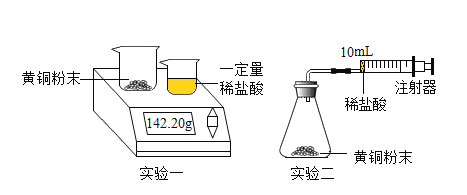
实验一:
称取10g黄铜样品粉末于大烧杯中,30g 稀盐酸于小烧杯中,将小烧杯中的稀盐酸分三次加入到大烧杯中,每次充分反应后,测定本次生成氢气的质量。
实验数据见下表。
第一次 | 第二次 | 第三次 | |
加入稀盐酸的质量(g) | 10 | 10 | 10 |
本次生成氢气的质量(g) | 0.04 | m | 0.02 |
(1)m=_____,
(2)此黄铜样品中铜的质量分数是多少?_____,
(3)在坐标系中画出生成氢气总质量与加入盐酸的质量关系图像_____,
实验二:
(4)先连接好装置并检查装置气密性,然后装好一定量样品,最后将10mL稀盐酸快速推入锥形瓶中。若缓慢推入,则可能造成的后果是_____。
(5) 实验记录如下(表中数据在相同温度、相同压强条件下测定):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
注射器读数/mL | 70.0 | 95.0 | 98.0 | 99.0 | 99.5 | 99.8 | 99.9 | 100.0 | 100.0 | 100.0 |
根据以上实验过程和数据综合分析,最终生成H2的体积是_____mL。