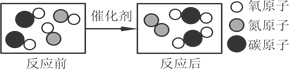
��Ŀ����
����Ŀ������֮�������ϵ���ҳ���ϵ�����ֹ���������ѧ�û�ѧ��һ�ֻ���������
(1)�ṹ�������ʣ��о����ֺ�����������(��O��O��)�������ʾ��к�ǿ�������ԣ�������ɱ�����������ݴ��Ʋ⣬���������У�������ɱ������������____________(���������)��
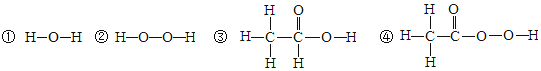
(2)�˵����Ϊ1��18��Ԫ�ص�ԭ�ӽṹʾ��ͼ����Ϣ��ͼ���ش��������⣺
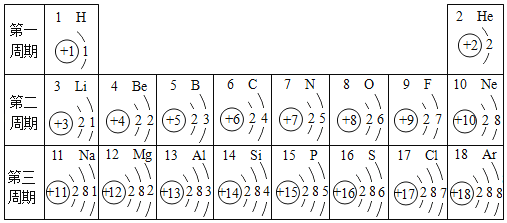
�ڵ�3�����У���ԭ�Ӻ�������Ų��ı仯������__________________��
(3)�ϱ�������(Be)Ԫ�ػ�ѧ�������Ƶ�Ԫ��Ϊ(��Ԫ������)____________��
(4)һ���˵�����Ӳ�����ͬ��ԭ��(ϡ���������)��ԭ�ӵİ뾶��ԭ�������ĵ�������С��������������ͬ��ԭ�ӣ�ԭ�ӵİ뾶����Ӳ��������Ӷ�������Ƚϣ�
��ԭ�Ӱ뾶____(��������������������ͬ)��ԭ�Ӱ뾶����ԭ�Ӱ뾶____��ԭ�Ӱ뾶��
(5)�о���������ͬһ�����У������ң�ԭ��ʧȥ���ӵ������������õ����ӵ���������ǿ���ɴ��ƶϣ����������еõ���������ǿ����_________ԭ�ӣ�ʧ����������ǿ����______ԭ�ӣ���������ȶ��ṹ����______ԭ�ӡ�
���𰸡� �ڢ� ������������1������8 þ �� �� �� �� �
����������1������������������С�����������-O-O-���������Ǣڢܣ����к�ǿ�������ԣ�������������
��2���ڵ��������У���ԭ�ӽṹ�Ĺ�֮ͬ����ԭ�Ӻ�����Ӳ�����ͬ���������У������ң���ԭ�Ӻ�������Ų��ı仯�����������������������ӣ�
��3��Ԫ�صĻ�ѧ����ȡ������������������(Be)��þ��Mg��Ԫ��ԭ��������������Ϊ2����������(Be)Ԫ�ػ�ѧ�������Ƶ�Ԫ��Ϊþ��
��4��ͬһ�����У�ԭ�ӵİ뾶��ԭ�������ĵ�������С��������������ͬ��ԭ�ӣ�ԭ�ӵİ뾶����Ӳ��������Ӷ�����������ԭ�Ӱ뾶����ԭ�Ӱ뾶����ԭ�Ӱ뾶����ԭ�Ӱ뾶��
��7���о���������ͬһ�����У������ң�ԭ��ʧȥ���ӵ������������õ����ӵ���������ǿ���ɴ��ƶϣ����������еõ���������ǿ������ԭ�ӣ�ʧ����������ǿ������ԭ������������ȶ��ṹ�����ԭ�ӡ�

 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д�