��Ŀ����
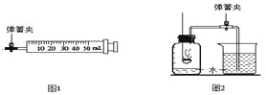
����Ŀ����ͼA��F��ʵ�����Ʊ�ijЩ���������װ��ʾ��ͼ��
A. B. C. D. F. E.
ʵ���ҳ�����������6%��˫��ˮ�ͺ�ɫ����ˮ�Ķ������̹����ĩ��ȡ������
��1��ʵ�����ô˷�����ȡ������Ӧѡ��ķ���װ��Ϊ ������дװ�����������Ӧ�Ļ�ѧ����ʽΪ ����װ�û���������ʵ������ȡ������̼���䷴Ӧ�ķ���ʽΪ ��
��2���ô˷�����ȡ����ʵ�������ʣ����������� ��
A����Һ B������Һ C������Һ D��������
��3��ʵ�����ø��������ȡ������Ӧ��������ȴ���Թ���������ٶ�����ȫ��Ӧ�������»��մ���:����֪�����������ˮ����������������ˮ��
��ͨ�������IJ��������ն������̡���ȷ�������Ⱥ�˳���� ����д�������
A����� B���ܽ� C������ D��ϴ��
�ڹ���ʱ���õ���ʵ��������:����̨������Ȧ����©��������ֽ�����ձ��� ��
��4��ʵ������Ҫ��ȡ������Ӧѡ�������е� ��Ϊ����װ������дװ�������������Eװ����ʹ�ù����е��ŵ��� ��
��5������ӻ�ѧƷ�̵�������˫��ˮ��Ũ��Ϊ30%���ܶ�1.11g/cm3������������50g6%��˫��ˮ����ʵ�飬����Ҫ30%��˫��ˮ mL����ˮ mL��
���𰸡���1��B��C��D 2H2O2 MnO2 2H2O+ O2�� CaCO3+2HCl=CaCl2+CO2��+H2O
��2��B ��3����BCDA �� ������
��4��B��C��D��E��F �濪���á������ͣ �����Կ��Ʒ�Ӧ�ķ�����ֹͣ��
��5��9.0ml 40ml
��������
�����������1�����巢��װ�õ�ѡ�����ݣ���Ӧ���״̬�ͷ�Ӧ��������˫��ˮ�Ͷ������̹�����ȡ��������������Һ�����������ʷ���װ��ѡ��B��C��D����Ӧ����ʽΪ��2H2O2 MnO2 2H2O+ O2����ʵ������ȡ������̼������ʯ��ʯ��ϡ���ᷴӦ����ѧ����ʽΪ�� CaCO3+2HCl=CaCl2+CO2��+H2O
��2�����ڶ������̲�����ˮ����ȡ����ʵ�������ʣ���������������Һ����ѡ B
��3���������������ȡ������Ӧ������ʣ�����������������������̣������������̲�����ˮ�������������ˮ������ȷʵ���������Ⱥ�˳�������ܽ���������ϴ�����������ѡBCDA
������ʱ���õ���ʵ��������:����̨������Ȧ����©��������ֽ�����ձ���������
��4��ʵ������ȡ���������ÿ���״��п����ϡ���ᷴӦ����������Һ�����������ʿ�ѡ�������װ��Ϊ��B��C��D��E��F ������Eװ����ʹ�ù����е��ŵ����濪���á������ͣ �����Կ��Ʒ�Ӧ�ķ�����ֹͣ��
��5��������Һϡ���������ʵ��������䣬�ʿ�����Ҫ30%��˫��ˮ�����Ϊx��
��ʽΪ��30%��x��1.11g/cm3=50g��6%��x=9.0ml��
ˮ������=50g-9.0ml��1.11g/cm3=40g����40ml

 Сѧ���AB��ϵ�д�
Сѧ���AB��ϵ�д� ABC����ȫ�ž�ϵ�д�
ABC����ȫ�ž�ϵ�д�����Ŀ�����������г��õĽ������������ѧϰ�ش���������
��1������Ԫ������Ȼ���зֲ��ܹ㣬�������������õĽ������粬���������� ��ʽ���ڣ����������Ի�����Ĵ��ڡ���������������Ȼ�����Կ������ʽ���ڡ����п������ʯ����Ϊ��ʯ�����Ŀ�����Ҫ�г�������������ȣ����������г��ý�������ұ����������һ������£���ѡ���������FeS2����������ԭ��֮һ��
ԭ��������ɵĶ����������Ⱦ������
��2������ʹ�õġ�ȡůƬ���У����ȼ�����Ҫ�ɷ������ۡ�����̿���Ȼ��ơ�ˮ�ȣ����ȼ���Ӵ��������Żᷢ�ȣ�ԭ������Ҫ�� �� �����ʹ�ͬ���òŻᡰ���⡱��
��3����һ�����Ͳ�������Fe���ڿ���������ȼ������������Ч������ʵ���Ҳ��û�ԭ���Ʊ�����Fe�ۣ���������ͼ��ʾ:
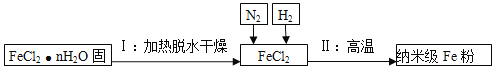
����������������բ��з����û���Ӧ�Ļ�ѧ����ʽ�����������뷴Ӧ��: ��
�����Ʊ�����Fe�۵Ĺ��������У�ͨ��N2��Ŀ���� ��
�ڶ����������ײ���MFe2OX��3<x<4����M��ʾ+2�۵Ľ���Ԫ�أ��ڷ�Ӧ�л��ϼ۲������仯�������£�MFe2OX��ʹ��ҵ�����е�SO2ת��ΪS��ת����������ͼ��ʾ:��֪MFe2Oy��FeΪ+3�ۡ�
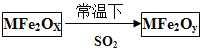
�۱Ƚ�X Y������ڡ����ڻ�С����
�ܸû�ѧ��Ӧ��SO2 �����ǻ�����������
��4��Ϊ���о���������Ҫ��Ӧԭ����ij��ѧ��ȤС���ͬѧ��һ����̼��ԭ��������ʵ�顣װ����ͼ��ʾ����ش���������:
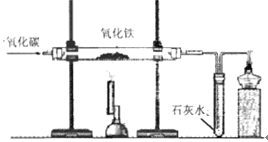
����װ��������������Բ��ڲ�������װ���ɫ��������ĩ���ʵ�����˳��Ϊ
A��ͨһ����̼
B����ȼ��Ӳ�ʲ����ܼ��ȵľƾ����
C����ȼ����β���ľƾ���
D������һ����̼�Ĵ���
��ʵ����Ӳ�ʲ������ڿ��Թ۲쵽������Ϊ:
�۽�̿��һ����̼������������������ʯ�е���������Ӧ���������Ͷ�����̼����д����̿����������Ӧ�ķ���ʽ:
���Ҳ�β��������ԭ���û�ѧ����ʽ��ʾΪ:
��ijѧУ�о���ѧϰС��Ϊ�˲ⶨij������������������������̼�Ͻ����к�̼��2��4.3%���Ƿ�ﵽҪ��ȡ����һЩ������Ʒ����ȡϡ����100g��ƽ���ֳ�4�ݣ�����ʵ�飬�������:
ʵ�� | 1 | 2 | 3 | 4 |
ϡ���������/g | 25 | 25 | 25 | 25 |
������Ʒ������/g | 3 | 6 | 9 | 12 |
���ɵ�H2����/g | 0.1 | 0.2 | 0.25 | m |
���ϱ��е�m����ֵΪ ��
���Լ�������������Ʒ��̼�������������ж��Ƿ�ﵽҪ����д��������̣�����������С�����һλ��
����Ŀ����������ʳ��Ľ���pH�жϣ�����˵����ȷ������ ��
ʳ�� | ������֭ | ƻ�� | ţ�� | ������ |
pH | 3.5��4.5 | 2.9��3.3 | 6.3��6.6 | 6.8��8.0 |
A��ƻ��֭������֭������
B������֭�����Ա�ƻ��֭ǿ
C���������ţ���Լ���
D��θ�������˲��˳���������