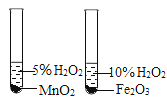题目内容
【题目】煤是重要的能源,也是生产化工产品的重要原料。随着人类社会的飞速发展,化石能源大量消耗,人类已经面临较严重的能源危机。为此,提高能源的利用率和开发更多的新能源显得相当重要。下图是煤化工产业链的一部分。
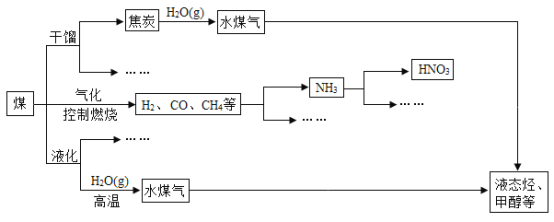
请回答:
(1)任意列举两种新能源______;
(2)上述处理煤的过程属于______(选填“物理”或“化学”)变化。
(3)煤和石油等化石燃料燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通人含有长石(地壳中最常见的矿石,含量高达60)成分的水溶液里,其中一种反应的化学方程式是:KAlSi3O8+CO2+2H2O=KHCO3+X↓+3SiO2↓,则X的名称是______;
(4)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理如下图所示:
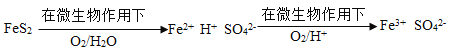
这种脱硫技术称为微生物脱硫技术。该技术的两步反应的化学方程式依次是:______。
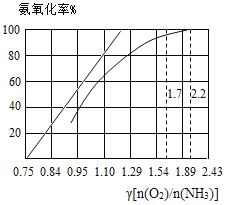
(5)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨—空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上γ[n(O2)/n(NH3)]=1.25,实际生产要将γ值维护在1.7 ~2.2之间,原因是________。
[温馨提示:n(O2)可以认为是表示氧气分子堆积数目的一种物理量,即n(O2)值越大,说明氧分子数目越多]
【答案】太阳能、氢能 化学 氢氧化铝 2FeS2+7O2+2H2O 2H2SO4+2FeSO4;2H2SO4+O2+4FeSO4
2H2SO4+2FeSO4;2H2SO4+O2+4FeSO4 2Fe2(SO4)3+2H2O 一方面提高氧气量,增大氨的氧化率;另一方面 γ 值在该范围,氨的氧化率已高达 95~99%, 再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本,所以而实际生产要将 γ 值 维持在 1.7~2.2 之间
2Fe2(SO4)3+2H2O 一方面提高氧气量,增大氨的氧化率;另一方面 γ 值在该范围,氨的氧化率已高达 95~99%, 再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本,所以而实际生产要将 γ 值 维持在 1.7~2.2 之间
【解析】
(1)常见的新能源有太阳能、地热能、氢能、风能、生物质能、核能等;
(2)煤的干馏、气化和液化都有新的物质产生,属于化学变化;
(3)根据化学方程式和质量守恒定律分析,反应前K:1个,反应后:1个,则x中不含K;反应前Al:1个,反应后应:1个,则x中含有一个Al,依此类推,x中还含有3个O,3个H,则X的化学式为 Al(OH)3,名称是氢氧化铝;
(4)第一步反应中反应物有FeS2、O2和H2O,生成物有Fe2+和SO42-,反应的方程式为:2FeS2+7O2+2H2O 2H2SO4+2FeSO4;Fe2+具有还原性,可被氧气氧化为Fe3+,方程式为:2H2SO4+O2+4FeSO4
2H2SO4+2FeSO4;Fe2+具有还原性,可被氧气氧化为Fe3+,方程式为:2H2SO4+O2+4FeSO4 2Fe2(SO4)3+2H2O;
2Fe2(SO4)3+2H2O;
(5)由氨氧化的化学方程式:4NH3+5O2 4NO+6H2O,可知氨氧化率达到100%,实际生产要将γ值维护在1.7-2.2之间,原因是浓度太少不利于NH3的转化,而γ值为2.2时NH3氧化率已近100%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本。
4NO+6H2O,可知氨氧化率达到100%,实际生产要将γ值维护在1.7-2.2之间,原因是浓度太少不利于NH3的转化,而γ值为2.2时NH3氧化率已近100%,再提高,氨的氧化率上升空间已有限,反而会增加能耗,提高生产成本。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】实验设计能实现其对应的实验目的是
|
|
|
|
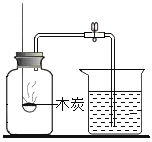
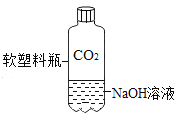
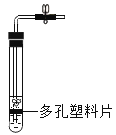
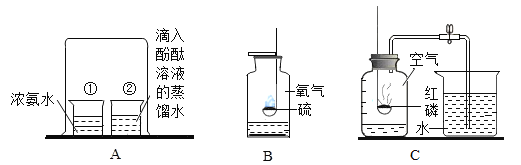
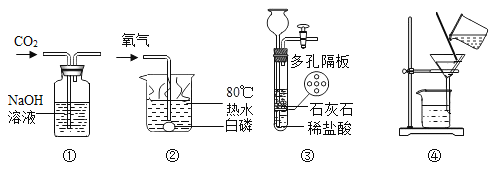
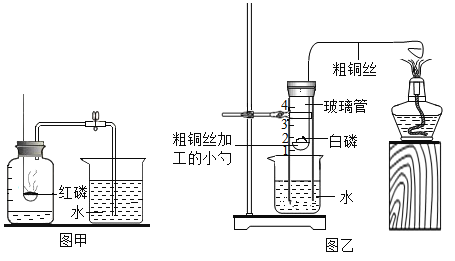
A. 测定空气中O2 的含量 | B. 证明 CO2 与NaOH溶液反应 | C. 比较 MnO2 和Fe2O3 的催化效果 | D. 此装置具有“启普发生器”的功能 |
A.AB.BC.CD.D