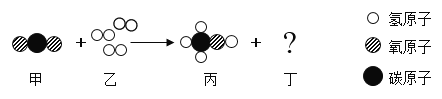
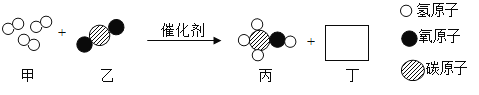
题目内容
【题目】某化学兴趣小组欲分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液。他们设计的实验流程如下图所示。供选试剂:K2SO4溶液、Na2CO3溶液、K2CO3溶液、盐酸、稀硫酸
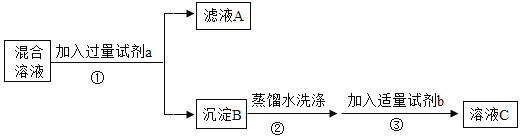
(1)步骤①中,分离A.B的实验操作名称是___________________。
(2)步骤③中,发生反应的化学方程式为___________________。
(3)要达到预期的目的,还需要改进的实验操作为___________________。
【答案】过滤 ![]() 在滤液A中,逐滴滴加稀盐酸,边滴边搅拌,直至不再产生气泡
在滤液A中,逐滴滴加稀盐酸,边滴边搅拌,直至不再产生气泡
【解析】
分离KCl和BaCl2混合溶液,得到都含单一溶质的两种溶液,可以先加入K2CO3溶液使氯化钡转化为碳酸钡沉淀和氯化钾溶液,过滤分离得到氯化钾溶液,再对沉淀碳酸钡加入盐酸转化为氯化钡,故试剂a为K2CO3溶液,试剂b为盐酸。
(1)步骤①是将沉淀与滤液分离,实验操作名称是过滤,故填:过滤。
(2)步骤③中碳酸钡与盐酸反应,反应生成氯化钡和水和二氧化碳,化学方程式为 2HCl+BaCO3= BaCl2+H2O+CO2↑,故填:2HCl+BaCO3= BaCl2+H2O+CO2↑。
(3)滤液A中含有过量碳酸钾,需要将碳酸钾转化为氯化钾,可以在滤液A中,逐滴滴加稀盐酸,边滴边搅拌,直至不再产生气泡,故填:在滤液A中,逐滴滴加稀盐酸,边滴边搅拌,直至不再产生气泡。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】碳酸钠用途非常广泛,是工业生产中重要的化工原料.在1921年我国科学家侯德榜创造了一种著名的纯碱生产方法﹣﹣“联合制碱法”.“联合制碱法”生产过程:
(1)第一步主要反应为NH3+CO2+H2O═NH4HCO3 该反应属于 反应基本反应类型.
(2)第二步用食盐与NH4HCO3反应.食盐来源于某盐田,该粗盐主要含有氯化钠,此外还含有少量硫酸钠,氯化钙和氯化镁.经净化、精制得到生产碳酸钠所需要的食盐水,其主要流程如图1:
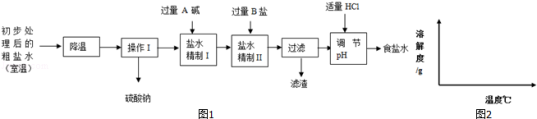
①通过降温使硫酸钠从粗盐水中析出,其原理是氯化钠和硫酸钠的溶解度与温度的变化差异较大,请在溶解度图(如图2)中简单画出氯化钠和硫酸钠的溶解度曲线变化趋势图.
②“精制I”操作中,加入过量含钙元素的碱的化学式是 .
其反应化学方程示为 .
③“精制II”操作中,加入B盐的有关反应方程式为 .
④为保证“精制II”操作中过量B盐把杂质全部除去,请在下表中写出检验溶液中B盐是否过量的实验报告.
实验操作 | 实验现象 | 实验结论 |
⑤查阅资料得知NaCl、NH4HCO3、NaHCO3、NH4Cl在30℃时的溶解度如下表所示:
温度 | NH4Cl | NH4HCO3 | NaHCO3 | NaCl |
30℃ | 41.1g | 27.0g | 11.1g | 36.3g |
请根据溶解度表所提供的信息,写出“联合制碱法”中的第二步属于复分解反应的化学方程式: .
(3)第三步处理制得碳酸钠,反应原理为2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑