��Ŀ����
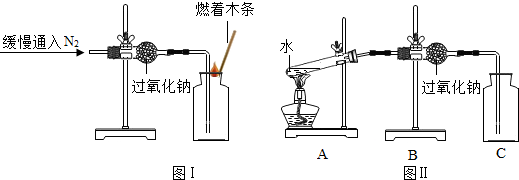
ijʵ��С���ʵ�����ƶ�����̼��Ӧ���ʵ�Ӱ�������Լ���Ӧ��IJ��������̽����
��̽��Ӱ�췴Ӧ���ʵ����أ�ʵ�����õ��Լ��ͷ�Ӧ�������£�
ʵ��С����Ƶ�ʵ�鷽���������±����������Ϣ�����ѱ����ȱ��д������
| ʵ���� | �¶� | ����ʯ | ����Ũ�� | ʵ��̽��Ŀ�� |
| �� | 20�� | �ֿ��� | 5% | ��ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ������Ӱ�죮 ��ʵ��ں�______̽���¶ȶԶԷ�Ӧ������Ӱ�죮 ��ʵ��ٺ͢�̽������ʯ��ϸ�Է�Ӧ������Ӱ�죮 |
| �� | 20�� | �ֿ��� | ______ | |
| �� | ______ | ϸ���� | 5% | |
| �� | 40�� | ______ | 10% |
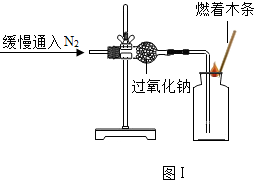
Ϊ������Һ������Ĵ��ڣ�ʵ��С��ͬѧ�����������������м��飬���ж���Щ�����Ƿ������д�����ɣ�
| ���� | ���Ƿ���� | ˵�����ɣ�д��ѧ����ʽ�� |
| ����Һ��pH�Ƿ�С��7 | ���� | �Ȼ�����������Һ������������ԣ� |
| �μ���������Һ�۲��Ƿ��а�ɫ�������� | ______ | ______�� |
| �����۹۲��Ƿ������� | ______ | ______�� |
��Ӧ����Һ���Ȼ��Ƶ������ⶨ��
�ձ���װ��һ�����ķ�Ӧ��Һ����̽����֪�÷�ҺΪ�Ȼ��ƺ�����Ļ����Һ�����к��Ȼ���3.65g��ʵ��С��Ϊ�˲ⶨ�����Һ���Ȼ��Ƶ����������ձ�����μ���10.6%��̼������Һ���õ�������������¼���£�
| ����̼������Һ������/g | 40.0 | 80.0 | 120.0 | 160.0 | 200.0 |
| ���ɳ���������/g | 0.0 | 3.0 | 7.0 | 10.0 | 10.0 |
��2���μӷ�Ӧ��̼������Һ���������Ƕ��ٿˣ�д��������̣�
��3��д���ڸû����Һ�м���̼������Һ�����������ɳ��������仯��ϵ�����ߣ�

�⣺��ٺ͢����Ƚϣ������������䣬ֻ�ı�Ũ�ȣ���ˢڵ�Ũ����10%���ں͢����Ƚϣ�ֻ�ı��¶ȣ���ˢ۵��¶�Ϊ20�棻���ٺ͢����Ƚϣ�̽����ϸ�Է�Ӧ�ٶȵ�Ӱ�죬������ֿ������ʴ�Ϊ����10%����20�棻�ֿܴ������ܣ�
����������ʯ��ʯ��Ӧ�����ɵ��Ȼ����к���Cl-��������������Ӧ���ɰ�ɫ�����Ȼ���������õμ���������Һ�۲��Ƿ��а�ɫ�������ɣ�������Һ������Ĵ����Dz������ģ��������������ᷴӦ����������������CaCl2��Ӧ���ʿ��У�
�ʴ�Ϊ����������AgNO3+HCl=AgCl��+HNO3��AgNO3+CaCl2=AgCl��+Ca��NO3��2��������Fe+2HCl=FeCl2+H2����
��1���ɼ�¼���ݱ���֪����̼������ȫ��Ӧ�����ɰ�ɫ����10g��
���ݻ�ѧ�仯ǰ��Ԫ���������䣬�����Һ���Ȼ��Ƶ�����=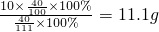
��3.65g�Ȼ��ⷴӦ����̼���Ƶ�����Ϊx��11.1gCaCl2��Ӧ����̼���Ƶ�����Ϊy��
Na2CO3+2HCl=CaCl2+H2O+CO2��
106 73
x 3.65g
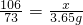
��֮��x=5.3g
Na2CO3+CaCl2=CaCO3��+2NaCl
106 100
y 10g
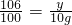
��֮��y=10.6g
����̼������Һ������Ϊ
��5.3+10.6����10.6%=150g
�ʴ�Ϊ����1��10g��11.1g��2��150g��3��
�����������Ƕ�ʵ������ȡCO2�����ʿ���Ӱ�����ص�̽����Ҳ�����˿��Ʊ�������������һ�����������������ֲ��䣮��Ŀ������ʵ��ʱ���õ��Լ���ʹ�õķ�Ӧ�������ٺ͢����Ƚϣ������������䣬ֻ�ı�Ũ�ȣ��ں͢����Ƚϣ�ֻ�ı��¶ȣ��ٺ͢����Ƚϣ�̽����ϸ�Է�Ӧ�ٶȵ�Ӱ�죮Ȼ�����ü�¼����ע�⻯ѧ����ʽ����ƽ��
��Ӧ�����Һ��һ�������Ȼ�����Һ��������������Һ���鷴Ӧ�����Һ���Ƿ������������
���ݱ���ʵ�����ݣ���������̼������Һ�ļ����ձ������ɳ��������ı仯��������̼������Һ���ձ������ɳ����������������ӣ�˵����Һ�е�������Ȼ�������ȫ��Ӧ��Ȼ�����ñ������ݼ��������Ӧ������
��������������Ҫ������Ӱ�컯ѧ��Ӧ���ʵ����ص�̽�����������˻�ѧ����ʽ����д���ۺ��ԱȽ�ǿ��Ҫ�ú����ÿ��Ʊ�������ϣ��ͬѧ������������ۺϰ��գ��ر���ʵ�鲽������еĶԱȣ�Ҫǰ����ϵ��ץסҪ�ı������������ͻ�ӭ�ж��⣮��������Ҫ������ʵ�����У�
����������ʯ��ʯ��Ӧ�����ɵ��Ȼ����к���Cl-��������������Ӧ���ɰ�ɫ�����Ȼ���������õμ���������Һ�۲��Ƿ��а�ɫ�������ɣ�������Һ������Ĵ����Dz������ģ��������������ᷴӦ����������������CaCl2��Ӧ���ʿ��У�
�ʴ�Ϊ����������AgNO3+HCl=AgCl��+HNO3��AgNO3+CaCl2=AgCl��+Ca��NO3��2��������Fe+2HCl=FeCl2+H2����
��1���ɼ�¼���ݱ���֪����̼������ȫ��Ӧ�����ɰ�ɫ����10g��
���ݻ�ѧ�仯ǰ��Ԫ���������䣬�����Һ���Ȼ��Ƶ�����=
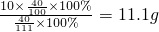
��3.65g�Ȼ��ⷴӦ����̼���Ƶ�����Ϊx��11.1gCaCl2��Ӧ����̼���Ƶ�����Ϊy��
Na2CO3+2HCl=CaCl2+H2O+CO2��
106 73
x 3.65g
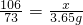
��֮��x=5.3g
Na2CO3+CaCl2=CaCO3��+2NaCl
106 100
y 10g
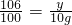
��֮��y=10.6g
����̼������Һ������Ϊ
��5.3+10.6����10.6%=150g
�ʴ�Ϊ����1��10g��11.1g��2��150g��3��

�����������Ƕ�ʵ������ȡCO2�����ʿ���Ӱ�����ص�̽����Ҳ�����˿��Ʊ�������������һ�����������������ֲ��䣮��Ŀ������ʵ��ʱ���õ��Լ���ʹ�õķ�Ӧ�������ٺ͢����Ƚϣ������������䣬ֻ�ı�Ũ�ȣ��ں͢����Ƚϣ�ֻ�ı��¶ȣ��ٺ͢����Ƚϣ�̽����ϸ�Է�Ӧ�ٶȵ�Ӱ�죮Ȼ�����ü�¼����ע�⻯ѧ����ʽ����ƽ��
��Ӧ�����Һ��һ�������Ȼ�����Һ��������������Һ���鷴Ӧ�����Һ���Ƿ������������
���ݱ���ʵ�����ݣ���������̼������Һ�ļ����ձ������ɳ��������ı仯��������̼������Һ���ձ������ɳ����������������ӣ�˵����Һ�е�������Ȼ�������ȫ��Ӧ��Ȼ�����ñ������ݼ��������Ӧ������
��������������Ҫ������Ӱ�컯ѧ��Ӧ���ʵ����ص�̽�����������˻�ѧ����ʽ����д���ۺ��ԱȽ�ǿ��Ҫ�ú����ÿ��Ʊ�������ϣ��ͬѧ������������ۺϰ��գ��ر���ʵ�鲽������еĶԱȣ�Ҫǰ����ϵ��ץסҪ�ı������������ͻ�ӭ�ж��⣮��������Ҫ������ʵ�����У�

��ϰ��ϵ�д�
 ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
�����Ŀ
ijʵ��С���ʵ�����ƶ�����̼��Ӧ���ʵ�Ӱ�������Լ���Ӧ��IJ��������̽����
��̽��Ӱ�췴Ӧ���ʵ����أ�ʵ�����õ��Լ��ͷ�Ӧ�������£�
ʵ��С����Ƶ�ʵ�鷽���������±����������Ϣ�����ѱ����ȱ��д������
��Է�Ӧ���Һ�ɷֵ�̽����
Ϊ������Һ������Ĵ��ڣ�ʵ��С��ͬѧ�����������������м��飬���ж���Щ�����Ƿ������д�����ɣ�
ʵ��֤�����÷�Һ�к����ᣮ
��Ӧ����Һ���Ȼ��Ƶ������ⶨ��
�ձ���װ��һ�����ķ�Ӧ��Һ����̽����֪�÷�ҺΪ�Ȼ��ƺ�����Ļ����Һ�����к��Ȼ���3.65g��ʵ��С��Ϊ�˲ⶨ�����Һ���Ȼ��Ƶ����������ձ�����μ���10.6%��̼������Һ���õ�������������¼���£�
��1���õ�������������Ϊ g���û��Һ���Ȼ��Ƶ�����Ϊ g��
��2���μӷ�Ӧ��̼������Һ���������Ƕ��ٿˣ�д��������̣�
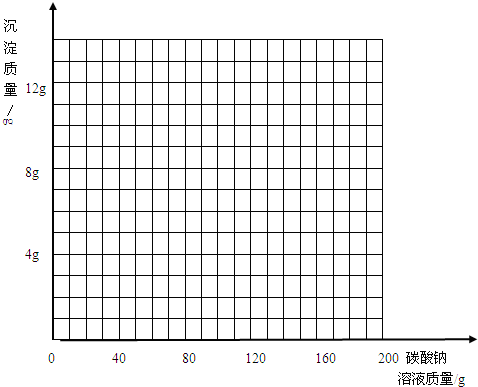
��3��д���ڸû����Һ�м���̼������Һ�����������ɳ��������仯��ϵ�����ߣ�
��̽��Ӱ�췴Ӧ���ʵ����أ�ʵ�����õ��Լ��ͷ�Ӧ�������£�

ʵ��С����Ƶ�ʵ�鷽���������±����������Ϣ�����ѱ����ȱ��д������
| ʵ���� | �¶� | ����ʯ | ����Ũ�� | ʵ��̽��Ŀ�� |
| �� | 20�� | �ֿ��� | 5% | ��ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ������Ӱ�죮 ��ʵ��ں� ��ʵ��ٺ͢�̽������ʯ��ϸ�Է�Ӧ������Ӱ�죮 |
| �� | 20�� | �ֿ��� | ||
| �� | ϸ���� | 5% | ||
| �� | 40�� | 10% |
Ϊ������Һ������Ĵ��ڣ�ʵ��С��ͬѧ�����������������м��飬���ж���Щ�����Ƿ������д�����ɣ�
| ���� | ���Ƿ���� | ˵�����ɣ�д��ѧ����ʽ�� |
| ����Һ��pH�Ƿ�С��7 | ���� | �Ȼ�����������Һ������������ԣ� |
| �μ���������Һ�۲��Ƿ��а�ɫ�������� | ||
| �����۹۲��Ƿ������� |
��Ӧ����Һ���Ȼ��Ƶ������ⶨ��
�ձ���װ��һ�����ķ�Ӧ��Һ����̽����֪�÷�ҺΪ�Ȼ��ƺ�����Ļ����Һ�����к��Ȼ���3.65g��ʵ��С��Ϊ�˲ⶨ�����Һ���Ȼ��Ƶ����������ձ�����μ���10.6%��̼������Һ���õ�������������¼���£�
| ����̼������Һ������/g | 40.0 | 80.0 | 120.0 | 160.0 | 200.0 |
| ���ɳ���������/g | 0.0 | 3.0 | 7.0 | 10.0 | 10.0 |
��2���μӷ�Ӧ��̼������Һ���������Ƕ��ٿˣ�д��������̣�
��3��д���ڸû����Һ�м���̼������Һ�����������ɳ��������仯��ϵ�����ߣ�

ijʵ��С���ʵ�����ƶ�����̼��Ӧ���ʵ�Ӱ�������Լ���Ӧ��IJ��������̽����
��̽��Ӱ�췴Ӧ���ʵ����أ�ʵ�����õ��Լ��ͷ�Ӧ�������£�
ʵ��С����Ƶ�ʵ�鷽���������±����������Ϣ�����ѱ����ȱ��д������
��Է�Ӧ���Һ�ɷֵ�̽����
Ϊ������Һ������Ĵ��ڣ�ʵ��С��ͬѧ�����������������м��飬���ж���Щ�����Ƿ������д�����ɣ�
ʵ��֤�����÷�Һ�к����ᣮ
��Ӧ����Һ���Ȼ��Ƶ������ⶨ��
�ձ���װ��һ�����ķ�Ӧ��Һ����̽����֪�÷�ҺΪ�Ȼ��ƺ�����Ļ����Һ�����к��Ȼ���3.65g��ʵ��С��Ϊ�˲ⶨ�����Һ���Ȼ��Ƶ����������ձ�����μ���10.6%��̼������Һ���õ�������������¼���£�
��1���õ�������������Ϊ______g���û��Һ���Ȼ��Ƶ�����Ϊ______g��
��2���μӷ�Ӧ��̼������Һ���������Ƕ��ٿˣ�д��������̣�
��3��д���ڸû����Һ�м���̼������Һ�����������ɳ��������仯��ϵ�����ߣ�

��̽��Ӱ�췴Ӧ���ʵ����أ�ʵ�����õ��Լ��ͷ�Ӧ�������£�

ʵ��С����Ƶ�ʵ�鷽���������±����������Ϣ�����ѱ����ȱ��д������
| ʵ���� | �¶� | ����ʯ | ����Ũ�� | ʵ��̽��Ŀ�� |
| �� | 20�� | �ֿ��� | 5% | ��ʵ��ٺ͢�̽��Ũ�ȶԷ�Ӧ������Ӱ�죮 ��ʵ��ں�______̽���¶ȶԶԷ�Ӧ������Ӱ�죮 ��ʵ��ٺ͢�̽������ʯ��ϸ�Է�Ӧ������Ӱ�죮 |
| �� | 20�� | �ֿ��� | ______ | |
| �� | ______ | ϸ���� | 5% | |
| �� | 40�� | ______ | 10% |
Ϊ������Һ������Ĵ��ڣ�ʵ��С��ͬѧ�����������������м��飬���ж���Щ�����Ƿ������д�����ɣ�
| ���� | ���Ƿ���� | ˵�����ɣ�д��ѧ����ʽ�� |
| ����Һ��pH�Ƿ�С��7 | ���� | �Ȼ�����������Һ������������ԣ� |
| �μ���������Һ�۲��Ƿ��а�ɫ�������� | ______ | ______�� |
| �����۹۲��Ƿ������� | ______ | ______�� |
��Ӧ����Һ���Ȼ��Ƶ������ⶨ��
�ձ���װ��һ�����ķ�Ӧ��Һ����̽����֪�÷�ҺΪ�Ȼ��ƺ�����Ļ����Һ�����к��Ȼ���3.65g��ʵ��С��Ϊ�˲ⶨ�����Һ���Ȼ��Ƶ����������ձ�����μ���10.6%��̼������Һ���õ�������������¼���£�
| ����̼������Һ������/g | 40.0 | 80.0 | 120.0 | 160.0 | 200.0 |
| ���ɳ���������/g | 0.0 | 3.0 | 7.0 | 10.0 | 10.0 |
��2���μӷ�Ӧ��̼������Һ���������Ƕ��ٿˣ�д��������̣�
��3��д���ڸû����Һ�м���̼������Һ�����������ɳ��������仯��ϵ�����ߣ�

 ��2011?���ݣ�ijѧϰС���������������о���
��2011?���ݣ�ijѧϰС���������������о���