题目内容
镁、铝、锌组成的混合物与足量的盐酸反应,产生氢气0.4g,则混合物的质量可能为( )A.15 g
B.10 g
C.3.6 g
D.3 g
解答:解:如果全用铝,设铝的质量为X则:X×
 =0.4g解得X=3.6g,如果全为锌设锌的质量为Y则:Y×
=0.4g解得X=3.6g,如果全为锌设锌的质量为Y则:Y×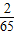 =0.4g解得Y=13g.
=0.4g解得Y=13g.由此可见,产生氢气0.4g,若全部为铝,则混合物质量最少为3.6g,若全为锌则混合物质量最大为13g,由于是混合物,因此混合物质量应介于3.6与13之间;
故选B.
点评:使用一定质量金属完全反应产生氢气质量=
 ,可简化计算.
,可简化计算. 
 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案人类的生产生活离不开金属材料.
(1)铝、铁、铜是使用比较广泛的金属.
①如图1所示用品中,利用金属导热性的是__________,延展性的是___________ (填字母序号).
②铝具有很好的抗腐蚀性能,原因是__________________________(用化学方程式表示).

(2)焊锡(锡铅合金)常用于焊接电子元件.下表是一些金属的熔点数据.
| 金属 | 锡 | 铅 | 铋 |
|
| 熔点/℃ | 231.9 | 327.5 | 271.3 | 320.9 |
①锡铅合金中某种金属的质量分数与合金的熔点有如图2所示的关系,
其中横坐标表示的是_________的质量分数(填字母序号).
A.锡 B.铅 C.无法确定
②保险丝由铋、铅、锡、镉组成,其熔点约为________ (填字母序号).
A.15~30℃ B.60~80℃ C.231~328℃
(3)金属钛(Ti)的合金广泛用于航空、航天及化学工业.工业上冶炼金属钛的过程是以钛矿石(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氯气为原料,在高温条件下制取TiCl4.其反应的化学方程式为:2FeTiO3 + 6C + 7Cl2  2TiCl4 + 2X + 6CO.然后用镁与TiCl4,在高温条件下反应生成金属钛和氯化镁.
2TiCl4 + 2X + 6CO.然后用镁与TiCl4,在高温条件下反应生成金属钛和氯化镁.
请根据以上信息回答下列问题:
①FeTiO3中钛元素的化合价为 . ②在制备TiCl4的反应中,X的化学式为 .
③镁与TiCl4反应的化学方程式为 .
(4)黄铜外观似黄金但质地坚硬.将炉甘石(ZnCO3)、赤铜(Cu2O)和木炭粉混合后加热到约800℃,得到一种锌和铜的合金即黄铜.发生的化学反应有:
 |
ZnCO3 === ZnO + CO2↑, 2Cu2O + C === 4Cu+CO2↑, 2ZnO + C === 2Zn+CO2↑
若原料中含72吨赤铜,充分反应后,理论上所得黄铜中铜的质量为多少?(写出计算过程)

 镉
镉