题目内容
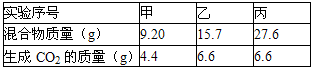
Ⅰ.取3份73克某浓度的盐酸,分别加入盛有NaHCO3和KHCO3组成的同一种混合物中,进行甲、乙、丙三组实验,测得如下数据(不考虑CO2在水中的溶解).
回答下列问题:
(1)盐酸的溶质质量分数为
(2)混合物中NaHCO3和KHCO3的质量比为
Ⅱ.已知固体混合物A由NaHCO3、KHCO3、MgCO3和CaCO3四种物质中的两种混合而成,通过计算和推理回答下列问题.
(1)取A与足量的盐酸反应,若A的质量为定值时,无论其组成成分的含量如何变化,生成的气体的量都为定值,则A的可能组成是(可以不填满,也可补充)
(2)若A是MgCO3和CaCO3组成的混合物,取10.0克的A与足量的盐酸反应,产生气体的质量x范围是多少?
| 实验序号 | 甲 | 乙 | 丙 |
| 混合物质量(g) | 9.20 | 15.7 | 27.6 |
| 生成CO2的质量(g) | 4.4 | 6.6 | 6.6 |
(1)盐酸的溶质质量分数为
7.5%
7.5%
;(2)混合物中NaHCO3和KHCO3的质量比为
21:25
21:25
.Ⅱ.已知固体混合物A由NaHCO3、KHCO3、MgCO3和CaCO3四种物质中的两种混合而成,通过计算和推理回答下列问题.
(1)取A与足量的盐酸反应,若A的质量为定值时,无论其组成成分的含量如何变化,生成的气体的量都为定值,则A的可能组成是(可以不填满,也可补充)
| (ⅰ) | (ⅱ) | (ⅲ) | |
| A的组成 | NaHCO3和MgCO3 NaHCO3和MgCO3 |
KHCO3和CaCO3 KHCO3和CaCO3 |
不需填满 不需填满 |
分析:Ⅰ、(1)要求盐酸的质量分数,则需选择盐酸全部参加反应的一组;对比表中数据可知:73g盐酸最多生成气体6.6g;依据二氧化碳的质量结合方程式分析解答;
(2)根据表中数据,甲组同学的固体混合物完全反应,据此结合二者与盐酸反应方程式分析解答;
Ⅱ、(1)由物质与盐酸反应方程式可知:若两种物质与二氧化碳的质量比相同,则混合物的质量为定值时,无论其组成成分的含量如何变化,生成的气体的量都为定值;
(2)根据极值法结合方程式分析求解.
(2)根据表中数据,甲组同学的固体混合物完全反应,据此结合二者与盐酸反应方程式分析解答;
Ⅱ、(1)由物质与盐酸反应方程式可知:若两种物质与二氧化碳的质量比相同,则混合物的质量为定值时,无论其组成成分的含量如何变化,生成的气体的量都为定值;
(2)根据极值法结合方程式分析求解.
解答:解:Ⅰ、
(1)NaHCO3和KHCO3与盐酸反应的方程式分别为:NaHCO3+HCl═NaCl+CO2↑+H2O,KHCO3+HCl═KCl+CO2↑+H2O,由方程式可知:HCl~CO2,据此关系式进行求解;
设73克某浓度的盐酸中溶质的质量是x
HCl~CO2
36.5 44
x 6.6g
=
解得x=5.475g
所以所用盐酸的溶质质量分数是
×100%=7.5%
故答案为:7.5%;
(2)用甲组数据解答;
设混合物中碳酸氢钠的质量为y,则碳酸氢钾的质量为9.2g-y,设碳酸氢钠对应的二氧化碳的质量为z.
NaHCO3+HCl═NaCl+CO2↑+H2O
84 44
y z
=
--------------①
KHCO3+HCl═KCl+CO2↑+H2O
100 44
9.2g-y 4.4g-z
=
---------②
根据①②解得:y=4.2g,即碳酸氢钠的质量为4.2g,碳酸氢钾的质量为5g.两者质量为4.2g:5g=21:25;
故答案为:21:25;
Ⅱ、
(1)据CaCO3+2HCl═CaCl2+CO2↑+H2O、KHCO3+HCl═KCl+CO2↑+H2O这两个方程式可看到:
CaCO3和KHCO3与二氧化碳的质量比都是100:44;所以混合物A中碳酸钙和碳酸氢钾质量比可以为任意比,生成的气体都为定值;
同样根据MgCO3+2HCl═MgCl2+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O这两个方程式可看到:
MgCO3和KHCO3与二氧化碳的质量比都是84:44;所以混合物A中碳酸镁和碳酸氢钠质量比可以为任意比,生成的气体都为定值;
故答案为:
(2)设10.0克的A中只含有碳酸镁,它与足量盐酸产生二氧化碳的质量为a;设10.0克的A中只含有碳酸钙,它与足量盐酸反应产生的二氧化碳的质量为b
MgCO3+2HCl═MgCl2+CO2↑+H2O
84 44
10.0g a
=
a=5.24g
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
10.0g b
=
b=4.40g
所以,产生气体的质量x范围是:4.40g<x<5.24g.
答:10.0克A与足量的盐酸反应,产生气体的质量x范围是4.40g<x<5.24g.
(1)NaHCO3和KHCO3与盐酸反应的方程式分别为:NaHCO3+HCl═NaCl+CO2↑+H2O,KHCO3+HCl═KCl+CO2↑+H2O,由方程式可知:HCl~CO2,据此关系式进行求解;
设73克某浓度的盐酸中溶质的质量是x
HCl~CO2
36.5 44
x 6.6g
| 36.5 |
| 44 |
| x |
| 6.6g |
解得x=5.475g
所以所用盐酸的溶质质量分数是
| 5.475g |
| 73g |
故答案为:7.5%;
(2)用甲组数据解答;
设混合物中碳酸氢钠的质量为y,则碳酸氢钾的质量为9.2g-y,设碳酸氢钠对应的二氧化碳的质量为z.
NaHCO3+HCl═NaCl+CO2↑+H2O
84 44
y z
| 84 |
| 44 |
| y |
| z |
KHCO3+HCl═KCl+CO2↑+H2O
100 44
9.2g-y 4.4g-z
| 100 |
| 44 |
| 9.2g-y |
| 4.4g-z |
根据①②解得:y=4.2g,即碳酸氢钠的质量为4.2g,碳酸氢钾的质量为5g.两者质量为4.2g:5g=21:25;
故答案为:21:25;
Ⅱ、
(1)据CaCO3+2HCl═CaCl2+CO2↑+H2O、KHCO3+HCl═KCl+CO2↑+H2O这两个方程式可看到:
CaCO3和KHCO3与二氧化碳的质量比都是100:44;所以混合物A中碳酸钙和碳酸氢钾质量比可以为任意比,生成的气体都为定值;
同样根据MgCO3+2HCl═MgCl2+CO2↑+H2O、NaHCO3+HCl═NaCl+CO2↑+H2O这两个方程式可看到:
MgCO3和KHCO3与二氧化碳的质量比都是84:44;所以混合物A中碳酸镁和碳酸氢钠质量比可以为任意比,生成的气体都为定值;
故答案为:
| (ⅰ) | (ⅱ) | (ⅲ) | |
| A的组成 | NaHCO3和MgCO3 | KHCO3和CaCO3 | 不需填满 |
MgCO3+2HCl═MgCl2+CO2↑+H2O
84 44
10.0g a
| 84 |
| 44 |
| 10.0g |
| a |
a=5.24g
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
10.0g b
| 100 |
| 10.0g |
| 44 |
| b |
b=4.40g
所以,产生气体的质量x范围是:4.40g<x<5.24g.
答:10.0克A与足量的盐酸反应,产生气体的质量x范围是4.40g<x<5.24g.
点评:本题综合性较强,主要考查了学生对数据的分析,及关于方程式的计算、物质组成的确定,难度较大,要结合相关知识,在细致分析题目信息的基础上进行解答.

练习册系列答案
 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
Ⅰ.取3份73克某浓度的盐酸,分别加入盛有NaHCO3和KHCO3组成的同一种混合物中,进行甲、乙、丙三组实验,测得如下数据(不考虑CO2在水中的溶解).
回答下列问题:
(1)盐酸的溶质质量分数为______;
(2)混合物中NaHCO3和KHCO3的质量比为______.
Ⅱ.已知固体混合物A由NaHCO3、KHCO3、MgCO3和CaCO3四种物质中的两种混合而成,通过计算和推理回答下列问题.
(1)取A与足量的盐酸反应,若A的质量为定值时,无论其组成成分的含量如何变化,生成的气体的量都为定值,则A的可能组成是(可以不填满,也可补充)
(2)若A是MgCO3和CaCO3组成的混合物,取10.0克的A与足量的盐酸反应,产生气体的质量x范围是多少?
| 实验序号 | 甲 | 乙 | 丙 |
| 混合物质量(g) | 9.20 | 15.7 | 27.6 |
| 生成CO2的质量(g) | 4.4 | 6.6 | 6.6 |
(1)盐酸的溶质质量分数为______;
(2)混合物中NaHCO3和KHCO3的质量比为______.
Ⅱ.已知固体混合物A由NaHCO3、KHCO3、MgCO3和CaCO3四种物质中的两种混合而成,通过计算和推理回答下列问题.
(1)取A与足量的盐酸反应,若A的质量为定值时,无论其组成成分的含量如何变化,生成的气体的量都为定值,则A的可能组成是(可以不填满,也可补充)
| (ⅰ) | (ⅱ) | (ⅲ) | |
| A的组成 | ______ | ______ | ______ |
 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,逐渐加入50克某浓度的稀盐酸.充分反应后,取出剩余固体,经过滤、干燥等操作后称量,剩余固体质量与所加盐酸的质量关系如图:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,逐渐加入50克某浓度的稀盐酸.充分反应后,取出剩余固体,经过滤、干燥等操作后称量,剩余固体质量与所加盐酸的质量关系如图: