题目内容
【题目】(10分)同学在帮助老师整理实验室时,发现了半瓶久置的氢氧化钙粉末,他们决定对这瓶氢氧化钙粉末的组成进行实验探究.
(1)提出问题:这瓶氢氧化钙是否已经变质?
(2)猜想与假设:该氢氧化钙粉末的成分为
I.氢氧化钙;
II.氢氧化钙、碳酸钙;
III._____①_________.
(3)设计方案、进行实验:请你参与探究,并填写下表
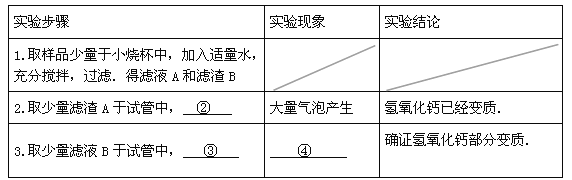
(4)联想与启示:氢氧化钙变质的原因___________⑤_________(用化学方程式表示),因此氢氧化钙应___⑥_____保存.
(5)【定量分析】为了进一步探究该氢氧化钙样品中各成分的质量,小组同学称取氢氧化钙样品12.4g于锥形瓶中,加入32.6g水,振荡形成悬浊液,向锥形瓶中逐滴滴加的稀盐酸,使其充分反应至无气体产生,测得加入盐酸的质量与锥形瓶中物质的质量关系如下表所示。
加入盐酸的质量/g | 0 | 25 | 37.5 |
锥形瓶中物质的质量/g | 45 | 70 | 80.3 |
(I)根据表中数据分析,加入盐酸的质量在0到25克时,仅有_⑦___与盐酸反应
(II)试求12.4g该样品中各成分的质量.
【答案】①碳酸钙 ②加适量稀盐酸 ③无色酚酞 ④由无色变为红色
⑤Ca(OH)2+CO2===H2O+CaCO3↓ ⑥密封 ⑦Ca(OH)2 (II) 氢氧化钙:7.4g 碳酸钙 5g
【解析】
试题分析:氢氧化钙完全变质后会是碳酸钙,部分变质会是氢氧化钙和碳酸钙;如果有碳酸钙存在用盐酸反应可以看到有大量的气泡产生,来检验是否存在碳酸钙从而确定是否变质;在滤液中加入无色酚酞,如果由无色变为红色,说明溶液显示碱性,说明溶液部分变质;因此氢氧化钙应该密封保存,向氢氧化钙和碳酸钙的化合物中加入稀盐酸时,稀盐酸先和氢氧化钙反应生成氯化钙和水,氢氧化钙完全反应后,稀盐酸再和碳酸钙反应生成氯化钙、水和二氧化碳,加入盐酸的质量在0﹣25g时,反应前后物质质量不变,说明是氢氧化钙和稀盐酸反应;反应产生二氧化碳的质量为:12.4g+32.6g+37.5g﹣80.3g=2.2g,设碳酸钙的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑,
100 44
x 2.2g
![]() =
=![]() ,
,
x=5g
所以氢氧化钙的质量为=12.4克-5克=7.4克。