题目内容
【题目】过氧化钙(CaO2)是一种环境友好的化工原料,工农业生产中用作漂白剂、种子消毒剂及鱼类运输时的制氧剂等。过氧化钙与水反应方程式为:![]() ,某同学把20g不纯的过氧化钙样品(杂质不与水反应)加入到盛有足量水的烧杯中,完全反应后,生成2.24L氧气(氧气的密度是1.43gL1)请计算:
,某同学把20g不纯的过氧化钙样品(杂质不与水反应)加入到盛有足量水的烧杯中,完全反应后,生成2.24L氧气(氧气的密度是1.43gL1)请计算:
(1)反应生成氧气的质量_____。(计算结果精确到0.1)
(2)该样品中过氧化钙的质量分数_____。
【答案】3.2g 72%
【解析】
用20g不纯的过氧化钙样品与水反应制取氧气,收集到氧气2.24L,利用氧气的密度求出氧气的质量,再用氧气的质量和方程式中物质间的质量比,求出过氧化钙的质量及质量分数。
(1)反应生成氧气的质量为:![]()
(2)解:设该样品中过氧化钙的质量x
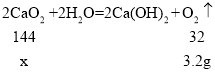
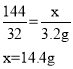
该样品中过氧化钙的质量分数为:![]()
答:该样品中过氧化钙的质量分数72%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】根据下面提供的溶解度表和溶解度曲线回答相关问题:
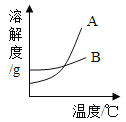
温度/℃ | 10 | 30 | 50 | 60 | 100 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 | 39.8 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | 246 | |
(1)A是_____的溶解度曲线(填“氯化钠”或“硝酸钾”);
(2)100℃时,100g水中加入200g硝酸钾,所得溶液是_____(填“饱和”或“不饱和”)溶液,将此溶液从100℃降温到60℃时,析出晶体的质量______g。