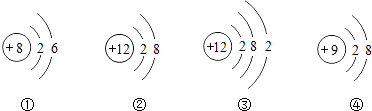题目内容
【题目】如图中①、②为氧元素、铝元素在元素周期表中的信息示意图,A,B,C,D是四种粒子的结构示意图. 
(1)氧元素属于元素(填“金属”或“非金属”);铝元素的质子数是 .
(2)C粒子属于(填“原子”、“阴离子”或“阳离子”);若D为原子,则x= .
(3)A,B,C,D中属于同种元素的是(填序号).
(4)A粒子的化学性质与B,C,D中哪一种粒子的化学性质相似(填序号).
(5)①和②组成化合物的化学式是 .
【答案】
(1)非金属;13
(2)阴离子;8
(3)BC
(4)B
(5)Al2O3
【解析】解:(1)氧元素的原子结构核外最外层电子为6,易得到电子形成稳定结构,属于非金属元素;根据铝元素在元素周期表中的信息示意图可知,铝元素的质子数是13.(2)C粒子性质的判定,从核内质子数是17,而核外电子数为2+8+8=18,可以看出外面电子多,所以应该为阴离子.而对于D原子,由于是核外电子数等于核内质子数,所以X=18﹣(2+8)=8.(3)属于同种元素的微粒,根据元素是具有相同质子数的原子的总称可知道,只要是单原子或者离子,核内质子数相同就属于同一元素的微粒,图中B、C质子数都是16,所以它们二者属于同一元素的微粒.所以答案是BC.(4)根据元素的化学性质取决于最外层电子数,A粒子的最外层电子数为6,B中硫原子的最外层电子数也为6,所以二者的化学性质相似.故填:B.(5)Al,O化合价分别是+3、﹣2,所以它们组成的化合物是Al2O3 .
故本题答案为:(1)非金属;13;(2)阴离子;8;(3)BC;(4)B(5)Al2O3;

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案【题目】如表是元素周期表中部分元素的信息,请回答下列问题:
第2周期 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne |
第3周期 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar |
(1)氧元素的相对原子质量是 , 氯元素的化学性质与表中元素(填元素符号)的化学性质相似;
(2)写出由12、17号两种元素组成的化合物的化学式;
(3)请画出16号元素的原子结构示意图 , 该元素的原子在化学反应中易(填“得到”或“失去”)电子;
(4)14号元素属于(填“金属”或“非金属”)元素,表中不同元素最本质的区别是(选填序号:A.相对原子质量不同 B.质子数不同 C.中子数不同).
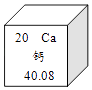
(5)如图是元素周期表中的一格,从中获取的信息错误的是
A.该元素的原子序数为20
B.该元素属于金属元素
C.该元素的原子核外有20个电子
D.该元素的相对原子质量为40.08克.