题目内容
【题目】潜水艇里要配备氧气的再生装置,以保证长时间潜航。有以下几种制取氧气的方法:
①加热高锰酸钾 ②用二氧化锰分解过氧化氢 ③常温下过氧化钠固体(化学式为Na2O2)与二氧化碳反应生成碳酸钠和氧气。
(1)写出方法①和②的化学方程式___,______。
(2)事实证明最适合在潜水艇里制氧气的是方法是③,与其它两种方法相比,这种方法的优点是____(填序号)。
A. 无需加热,常温下就可自动完成,使用方便
B. 能将人呼吸产生的二氧化碳转变为呼吸所需的氧气
C. 生成等质量的氧气,药品用量少
D. 生成物没有毒,不污染环境
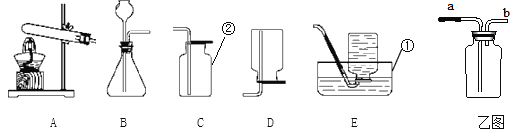
探究一:某同学设计了下图所示的实验装置来探究过氧化钠和二氧化碳反应产生氧气。
(查阅资料)已知过氧化钠是一种浅黄色固体粉末,过氧化钠还能与水反应生成氢氧化钠和氧气,方程式为:2Na2O2 + 2H2O == 4NaOH + O2↑。
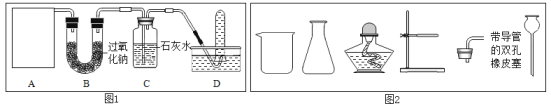
(3)A是二氧化碳气体的发生装置,装配该装置时,应选用的仪器除带导管的双孔橡皮塞外,还需要的仪器有(填名称,从图2中选择)_____、_____。实验室制取二氧化碳的化学方程式______。
(4)用图1中装置D所示的方法收集氧气,其依据是_______;检验D装置试管内收集到的气体是否是氧气的方法是_________。
(5)B中反应方程式是___________。
石灰水的作用是①观察气体的流速,②判断过氧化钠与二氧化碳何时完全反应, ③_____________。
(6)你认为该方案_______(填“能”或“不能”)证明过氧化钠与二氧化碳反应生成氧气,理由是_______。
探究二:小红同学利用过氧化钠能和水反应的原理来测定Na2O2的纯度并用所得的氧气来确定某物质的组成
(实验步骤):
①称取20g样品置于装置中(整个装置的质量为45g)。
②一次性加入20mL蒸馏水后将装置放置在电子天平上,观察显示数字的变化,并记录(数据见下表)。
③进行计算。
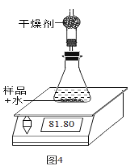
时间/s | 60 | 120 | 180 | 240 | 300 |
天平示数/g | 83.82 | 82.43 | 82.15 | 81.80 | 81.80 |
(7)装置中干燥剂的作用是______;如果没有干燥剂,测定结果会_____(选填“偏大”、“ 偏小”、“ 不变”)。
(8)取一定质量的某物质在上述所得的氧气中完全燃烧测得生成二氧化碳4.4克和水1.8克,通过计算确定该物质中各元素的原子的个数比_____。
【答案】2KMnO4![]() K2MnO4+MnO2+O2↑ 2H2O2
K2MnO4+MnO2+O2↑ 2H2O2![]() 2H2O+O2↑ AB 锥形瓶 长颈漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ 氧气不易溶于水 带火星的木条伸入试管中 2Na2O2+2CO2=2Na2CO3+O2 除去氧气中的二氧化碳 不能 过氧化钠与二氧化碳中的水蒸气反应也生成氧气 吸收氧气逸出时带出的水蒸气 偏大 1:2:1
2H2O+O2↑ AB 锥形瓶 长颈漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ 氧气不易溶于水 带火星的木条伸入试管中 2Na2O2+2CO2=2Na2CO3+O2 除去氧气中的二氧化碳 不能 过氧化钠与二氧化碳中的水蒸气反应也生成氧气 吸收氧气逸出时带出的水蒸气 偏大 1:2:1
【解析】
(1)加热高锰酸钾生成锰酸钾、二氧化锰和氧气,反应的化学方程为:2KMnO4![]() K2MnO4+MnO2+O2↑;用二氧化锰分解过氧化氢生成水和氧气,反应的化学方程为:2H2O2
K2MnO4+MnO2+O2↑;用二氧化锰分解过氧化氢生成水和氧气,反应的化学方程为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)在常温下过氧化钠固体与二氧化碳反应生碳酸钠和氧气,常温下即可发生反应,且可把空气中的二氧化碳转化为氧气,供给氧气的同时吸收了人呼出的二氧化碳,适宜在潜水器里供给氧气;与其他两种方法相比,这种方法常温下就能进行,不用加热、不用通电,操作简单,还能将人呼吸产生的二氧化碳转变为呼吸所需的氧气;
(3)实验室通常用碳酸钙和稀盐酸反应制取二氧化碳气体,制取气体的反应物是固体和液体,反应不需要加热,因此所需的仪器有锥形瓶、长颈漏斗、带导管的橡皮塞等;实验室制取二氧化碳的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(4)用D所示的方法收集氧气,其依据是:氧气不溶于水;氧气能使带火星的木条复燃,故用燃着的木条伸入试管中,木条复燃,该气体是氧气;
(5)B中是过氧化钠能与二氧化碳反应生成碳酸钠和氧气,反应的化学方程为:2Na2O2+2CO2=2Na2CO3+O2;石灰水能与二氧化碳反应,防止对氧气收集的影响;
(6)过氧化钠还能与水反应生成氢氧化钠和氧气,故此方案不能明过氧化钠与二氧化碳反应生成氧气;
(7)过氧化钠还能与水反应生成氢氧化钠和氧气,氧气逸出时会带有水分,可用干燥剂进行吸收;没有干燥剂,氧气逸出时会带有水分,导致测得参加反应过氧化钠的质量偏大,计算的纯度偏大;
(8)根据质量守恒定律可得参加反应氧气的质量=20g+45g+20g-81.80g=3.2g,根据反应前后元素的种类不变,该物质中一定含有碳、氢两种元素,则:4.4g二氧化碳中碳元素的质量=4.4g×![]() ×100%=1.2g,1.8g水中氢元素的质量=1.8g×
×100%=1.2g,1.8g水中氢元素的质量=1.8g×![]() ×100%=0.2g,参加反应该物质的质量=4.4g+1.8g-3.2g=3.0g,1.2g+0.2g=1.4g, 故该气体中还含有氧元素,且氧元素的质量为:3.0g-1.4g=1.6g,所以碳、氢、氧元素的原子个数比=
×100%=0.2g,参加反应该物质的质量=4.4g+1.8g-3.2g=3.0g,1.2g+0.2g=1.4g, 故该气体中还含有氧元素,且氧元素的质量为:3.0g-1.4g=1.6g,所以碳、氢、氧元素的原子个数比=![]() :
:![]() :
:![]() =1:2:1。
=1:2:1。

 阅读快车系列答案
阅读快车系列答案