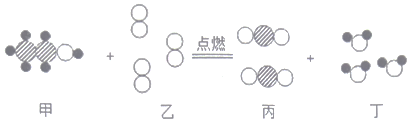
题目内容
【题目】BaCl2是一种重金属盐,其水溶液具有很强的毒性,若误服了BaCl2溶液,可立即服用MgSO4溶液解毒,为测定某BaCl2溶液的溶质质量分数,现取100克BaCl2溶液,不断加入MgSO4溶液,反应过程中溶液总质量与加入MgSO4溶液的质量关系如图所示,请回答:

(1)反应生成沉淀的最大质量时消耗硫酸镁溶液质量为______克;
(2)求原BaCl2溶液的溶质质量分数______。
【答案】100 20.8%
【解析】
(1)根据图可以看出加入100g 硫酸镁溶液时沉淀达到最大量,根据质量守恒定律可得硫酸钡的质量100g+100g-176.7g=23.3g;
(2)设原BaCl2溶液的溶质质量分数为x。

x=20.8%
答:原BaCl2溶液的溶质质量分数为20.8%。
故答案为:
(1)100;
(2)20.8%。

【题目】某实验小组为了测定实验中氯酸钾样品的纯度,取一定质量的该样品与1g二氧化锰混合,其总质量为6g。依次加热该混合物T1、T2、T3、T4时间后,分别冷却称量剩余固体质量,记录的有关数据见下表:
加热时间 | T1 | T2 | T3 | T4 |
剩余固体质量 | 4.24g | 4.16g | 4.08g | 4.08g |
反应的化学方程式为:2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
(1)完全反应后,产生的氧气的总质量为________,你的依据是_____________。
(2)样品中氯酸钾的纯度是多少?_____(氯酸钾样品纯度是指样品中氯酸钾的质量分数)
【题目】图表法是一种常用的数据处理方法,根据所给图表(氢氧化钠、碳酸钠分别在水、酒精中的溶解度如表所示),下列说法正确的是( )
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |

A. 上述图象表示碳酸钠的溶解度曲线
B. 20℃时,氢氧化钠的溶解度大于碳酸钠
C. 40℃时,若将 50g NaOH 分别投入到 100g 水和 100g 酒精中,都能形成饱和溶液
D. 40℃时,将适量 CO2 通入饱和的 NaOH 酒精溶液中,观察不到明显的现象
【题目】有A、B两种酸碱指示剂,它们显示的颜色与溶液pH的关系如图,它们在甲溶液和乙溶液中显示的颜色如表。下列判断错误的是( )
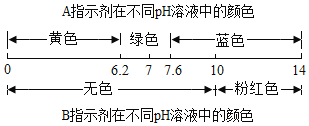
溶液 | 甲 | 乙 |
A | 黄色 | 蓝色 |
B | 无色 | 粉红色 |
A.甲溶液呈酸性
B.在滴有A指示剂的甲溶液中不断加入乙溶液,最后溶液一定呈绿色
C.乙溶液的pH可能为11
D.只用A指示剂就能鉴别甲溶液、乙溶液和蒸馏水三种液体