��Ŀ����
����Ŀ�����ձ��м���2.4g���õ�����,�ٵμ�ϡ����,����ȫ���ܽ�,�ų����������������ϡ���������Ĺ�ϵ����ͼ��ʾ����ش���������:
��1����������������Ϊ_______g���ų����������Ϊ__________g��
��2������2.4g���õ������н���������������(д���������)___________��
��3��ʵ��տ�ʼû�����ݲ�����ԭ����_________________________�����õ�������ϡ����ǡ����ȫ��Ӧʱ������Һֻ��һ������,����������__________(�û�ѧʽ���)����ʱ��Һ����Ϊ__________g.
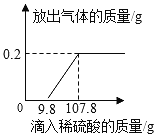
���𰸡�0.2 0.2 88%(������̼�����) ��Ϊ����������һ�����ܵ���������ϡ�����������������Ӧ������������ˮ��û���������� Al2(SO4)3 108g
��������
�⣺��1) ��Ϊ���õ�����������һ�����ܵ���������ϡ�����������������Ӧ������������ˮ��������Ĥ��Ӧ����ϡ���������Ӧ��������������������������Ӧ�����в�����������������Ϊ�����������������������е�ͼʾ֪������������������=�������������=0.2g��
��2)������0.2g������Ҫ��������Ϊx��

![]() ��x=1.8g��
��x=1.8g��
�����б�����������������Ԫ������Ϊ![]() 0.318g
0.318g
��2.4g���õ������н���������������![]() 88%
88%
����������Ԫ�ص���������Ϊ88%��
��3����Ϊ����������һ�����ܵ���������ϡ�����������������Ӧ������������ˮ��û���������ɣ���ʵ��տ�ʼû�����ݲ�����������Ĥ��Ӧ����ϡ���������Ӧ�������������������ʾ��õ�������ϡ����ǡ����ȫ��Ӧʱ������Һֻ��һ�����ʣ���������������������ѧʽΪAl2(SO4)3����ͼʾ��֪����ϡ���ᵽ107.8gʱ��ֹͣ�������壬˵����ʱ���Ѿ���ȫ��Ӧ����ʱ��Һ������Ϊ107.8g+2.4g-0.2g=108g��

 ���������ν�ϵ�д�
���������ν�ϵ�д�