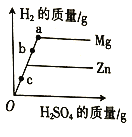
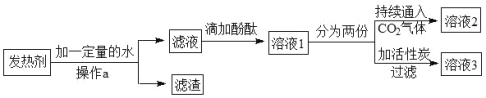
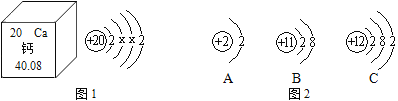
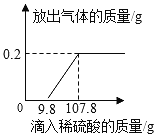
题目内容
【题目】取氯酸钾和二氧化锰的混合物 30g,加热一段时间后冷却,称得剩余固体质量为 20.4g,将剩余固体加入足量的水中,充分搅拌后过滤,得到的滤渣经洗涤、烘干后称量为 1.5g。计算:(根据化学方程式列式计算)
(1)生成氧气_____mol。
(2)反应后剩余固体的成分及相应的质量。_____
【答案】0.3 1.5gMnO2、14.9gKCl、4gKClO3
【解析】
解:(1)根据质量守恒定律,生成氧气的质量是30g-20.4g=9.6g,为![]() =0.3mol
=0.3mol
(2)二氧化锰在反应中作催化剂,反应前后其质量不变,且不溶于水,将剩余固体加入足量的水中,充分搅拌后过滤,得到的滤渣经洗涤、烘干后称量为 1.5g,1.5g是二氧化锰,则反应前混合物中含有氯酸钾的质量是30g-1.5g=28.5g。
设参加反应的氯酸钾的质量是x,生成氯化钾的是y。
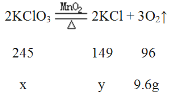
![]() =
= ![]() ,解得x=24.5g,反应后剩余氯酸钾的质量是28.5g-24.5g=4g
,解得x=24.5g,反应后剩余氯酸钾的质量是28.5g-24.5g=4g
![]() =
=![]() ,解得y=14.9g
,解得y=14.9g
反应后剩余固体中含有1.5g二氧化锰、4g氯酸钾、14.9g氯化钾。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校兴趣小组的同学在综合实践活动中,从水泥厂拿来一块石灰石样品,技术员告诉他们此样品中含有的杂质是二氧化硅,二氧化硅难溶于水,不能与盐酸反应。为了测定该石灰石的纯度,兴趣小组的同学取用8.00g这种石灰石样品,用实验室现有的未知溶质质量分数的稀盐酸100克分5次加入,充分反应后,经过滤、干燥等操作后称量,得到如下数据:
实 验 次 数 | 1 | 2 | 3 | 4 | 5 |
加入稀盐酸的质量/g | 20.0 | 20.0 | 20.0 | 20.0 | 20.0 |
剩余固体的质量/g | 6.00 | m | 2.00 | 1.20 | 1.20 |
试回答下列问题
(l)表中m的值为_____g.
(2)计算该石灰石样品的纯度______。
(3)反应生成的气体质量是________克?(保留两位小数)