题目内容
【题目】在粗盐的提纯实验中
(1)其主要操作步骤顺序是______。
①过滤 ②溶解 ③蒸发 ④计算产率
(2)蒸发时,蒸发皿内出现____时应停止加热。
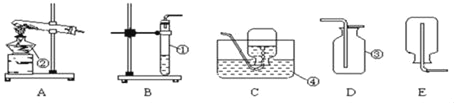
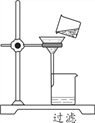
(3)如图是某同学过滤的操作图,指出图中明显错误______;过滤后,如果滤液仍然浑浊,其原因可能是____。(填一种)
(4)通过以上操作只能除去粗盐中难溶性杂质,欲除去可溶性杂质MgCl2、CaCl2得到纯净的NaCl,可采用如下图所示流程:
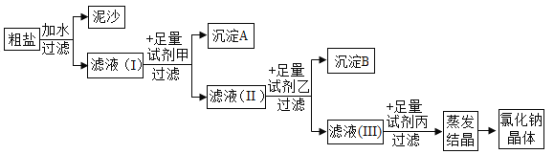
①上图中所用甲、乙、丙三种试剂依次是____。
A NaOH溶液、Na2CO3溶液、稀盐酸
B Na2CO3溶液、KOH溶液、稀盐酸
C NaOH溶液、Na2CO3溶液、稀硫酸
步骤I和步骤II能否互换 (填“能”或“否”)___;加入足量试剂丙的作用是___。
②反思交流:通过以上规范操作,制得氯化钠的质量比原粗盐样品中含氯化钠的质量___(填“增多”、“减少”、“不变”)。
(5)实验室用氯化钠固体配制50g15%的氯化钠溶液
①在溶解过程中,玻璃棒的作用是____。
②下列操作中,可能导致配制氯化钠溶液的溶质质量分数偏大的是____(填序号)。
a.称取时,将氯化钠置于托盘天平的右盘 b.量取水时俯视读数
c.用已有少量水的烧杯溶解氯化钠 d.转移时,有少量溶液溅出
【答案】②①③④ 较多量固体 没有使用玻璃棒引流 滤纸破损 A 能 除去过量的氢氧化钠和碳酸钠,将之转化为氯化钠 增多 搅拌,加快氯化钠的溶解速率 b
【解析】
(1)根据粗盐提纯的步骤来分析;
(2)根据蒸发结晶的注意事项来分析;
(3)根据过滤操作的注意事项来分析;
(4)根据除去粗盐中的可溶性杂质的方法、误差产生的原因来分析;
(5)根据配制溶液过程中玻璃棒的作用、误差产生的原因来分析
(1)粗盐提纯时除去不溶性杂质的操作步骤是溶解、过滤、蒸发和计算产量,故填:②①③④;
(2)蒸发时,当蒸发皿内出现较多量固体时应停止加热,故填:较多量固体;
(3)图中的操作是过滤,图中明显的错误是:没有使用玻璃棒引流;过滤后,如果滤液仍然浑浊,可能是因为滤纸破损或漏斗内的液面高于滤纸的边缘;
(4)①要除去可溶性杂质MgCl2、CaCl2得到纯净的NaCl,加入试剂及其顺序为氢氧化钠溶液、碳酸钠溶液、稀盐酸,故填:A;
可以先除氯化钙,也可以先除氯化镁,所以步骤I和步骤II能互换;试剂丙的作用是将过量的氢氧化钠、碳酸钠转化为氯化钠,所以丙是稀盐酸;
②通过以上规范操作,有氯化钠生成,故制得氯化钠的质量比原粗盐样品中含氯化钠的质量会增多;
(5)①在溶解过程中,玻璃棒的作用是:搅拌,加快氯化钠的溶解速率;
②a.称取时,将氯化钠置于托盘天平的右盘,导致溶质质量偏小,溶质质量分数偏小,故错;
b.量取水时,俯视读数,量取水的体积偏小,溶质质量分数偏大,故正确;
c.溶解时,烧杯内壁有水导致水多了,溶质质量分数偏小,故错;
d.装瓶时,有少量溶液洒出溶质质量分数不变,故错。
故填:b。