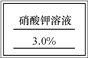
题目内容
【题目】工业烟气通常含有二氧化硫,在排放前需经脱硫处理。如图是两种常用脱硫工艺中含硫物质的转化路径(部分产物已略)。请回答下列问题:
双碱法:![]()
![]()
![]()
![]()
![]()
钠碱法:![]()
![]()
![]()
(1)反应Ⅰ的化学方程式是________________________________。
(2)反应Ⅱ所属的基本反应类型是______________,CaSO3中Ca、S、O元素的质量比是____________。
(3)已知原料NaOH的价格为2.9元/kg、Ca(OH)2的价格为0.36元/kg。两种工艺中,处理相同质量的SO2,双碱法所需的原料成本更低,其原因是________________________。
【答案】 SO2+2NaOH===Na2SO3+H2O 复分解反应 5∶4∶6 通过反应Ⅱ实现了NaOH的循环利用,减少了NaOH的用量,所以成本降低
【解析】 (1). 二氧化硫和氢氧化钠反应生成亚硫酸钠和水,反应方程式为:SO2+2NaOH===Na2SO3+H2O ;(2). 亚硫酸钠和氢氧化钙相互交换成分生成亚硫酸钙沉淀和氢氧化钠,是复分解反应 ; (3). CaSO3中Ca、S、O元素的质量比是40:32:48=5∶4∶6 (4). 双碱法所需的原料成本更低,其原因是通过反应Ⅱ实现了NaOH的循环利用,减少了NaOH的用量,所以成本降低。

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目