题目内容
(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母)______(A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性)关系最大;目前世界上已有50%以上的废钢铁得到回收利用,其目的是______(A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈);生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.写出其中一个反应的化学方程式______,其反应类型是______.若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是______、______.
(2)A、B两种固体物质溶解度曲线如图所示.
①t1℃时,A和B的溶解度大小关系是______.
②把t1时,A和B的饱和溶液变成不饱和溶液,除了升高温度外,还可以采取的方法有______.
③t2℃时,A的溶解度为25g,在t2℃时,向50g水中加入20g的A物质,充分溶解所得溶液的溶质质量分数为______.
④A中混有少量的杂质B,若想得到较为纯净的A,可以采用的方法是______.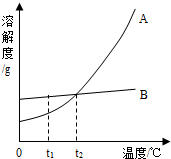
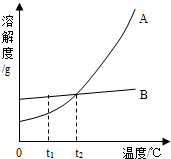
(2)A、B两种固体物质溶解度曲线如图所示.
①t1℃时,A和B的溶解度大小关系是______.
②把t1时,A和B的饱和溶液变成不饱和溶液,除了升高温度外,还可以采取的方法有______.
③t2℃时,A的溶解度为25g,在t2℃时,向50g水中加入20g的A物质,充分溶解所得溶液的溶质质量分数为______.
④A中混有少量的杂质B,若想得到较为纯净的A,可以采用的方法是______.

(1)金属的活动性越强,越难冶炼,大规模被使用越晚.废钢铁的回收利用可以节约金属资源;生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.首先是铁制品表面的锈与盐酸反应,当锈反应完,里面的铁与盐酸反应.其中铁与盐酸反应的化学方程式是:Fe+2HCl=FeCl2+H2↑,该反应有一种单质和化合物反应生成了另一种一种单质和化合物,属于置换反应.若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,他还需要的另外两种溶液是硝酸银、硫酸锌;
(2))①由溶解度曲线可知,t1℃时,A和B的溶解度大小关系是B>A;
②将饱和溶液转变成不饱和溶液可采取加入水的方法;
③由t2℃时,A的溶解度为25g可知,在t2℃时,向50g水中加入20g的A物质得到的溶液为饱和溶液,饱和溶液的溶质的质量分数是:
×100%=20%;
④由于A的溶解度受温度影响变化大,B的溶解度受温度影响变化小,所以我们在A中混有少量的B时,可用冷却热饱和溶液的方法来分离A.
故答为:(1)C,A,Fe+2HCl=FeCl2+H2↑,置换反应,硝酸银、硫酸锌;(2)①B>A;②加入水;③20%,④冷却热饱和溶液.
(2))①由溶解度曲线可知,t1℃时,A和B的溶解度大小关系是B>A;
②将饱和溶液转变成不饱和溶液可采取加入水的方法;
③由t2℃时,A的溶解度为25g可知,在t2℃时,向50g水中加入20g的A物质得到的溶液为饱和溶液,饱和溶液的溶质的质量分数是:
| 25g |
| 100g+25g |
④由于A的溶解度受温度影响变化大,B的溶解度受温度影响变化小,所以我们在A中混有少量的B时,可用冷却热饱和溶液的方法来分离A.
故答为:(1)C,A,Fe+2HCl=FeCl2+H2↑,置换反应,硝酸银、硫酸锌;(2)①B>A;②加入水;③20%,④冷却热饱和溶液.

练习册系列答案
相关题目

 (2012?宿迁)(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母)
(2012?宿迁)(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母) B、
B、 C、
C、 D、
D、
 (1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母)______(A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性)关系最大;目前世界上已有50%以上的废钢铁得到回收利用,其目的是______(A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈);生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.写出其中一个反应的化学方程式______,其反应类型是______.若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是______、______.
(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母)______(A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性)关系最大;目前世界上已有50%以上的废钢铁得到回收利用,其目的是______(A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈);生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.写出其中一个反应的化学方程式______,其反应类型是______.若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是______、______.