题目内容
 (1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母)______(A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性)关系最大;目前世界上已有50%以上的废钢铁得到回收利用,其目的是______(A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈);生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.写出其中一个反应的化学方程式______,其反应类型是______.若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是______、______.
(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母)______(A.地壳中金属元素的含量 B.金属的导电性 C.金属的活动性)关系最大;目前世界上已有50%以上的废钢铁得到回收利用,其目的是______(A.节约金属资源 B.合理开采矿物 C.防止钢铁生锈);生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.写出其中一个反应的化学方程式______,其反应类型是______.若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是______、______.
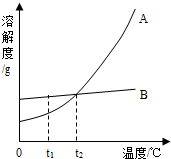
(2)A、B两种固体物质溶解度曲线如图所示.
①t1℃时,A和B的溶解度大小关系是______.
②把t1时,A和B的饱和溶液变成不饱和溶液,除了升高温度外,还可以采取的方法有______.
③t2℃时,A的溶解度为25g,在t2℃时,向50g水中加入20g的A物质,充分溶解所得溶液的溶质质量分数为______.
④A中混有少量的杂质B,若想得到较为纯净的A,可以采用的方法是______.
解:(1)金属的活动性越强,越难冶炼,大规模被使用越晚.废钢铁的回收利用可以节约金属资源;生锈的铁制品放入盛有过量稀盐酸的洗槽中,观察到溶液变黄,有无色气泡逸出.首先是铁制品表面的锈与盐酸反应,当锈反应完,里面的铁与盐酸反应.其中铁与盐酸反应的化学方程式是:Fe+2HCl=FeCl2+H2↑,该反应有一种单质和化合物反应生成了另一种一种单质和化合物,属于置换反应.若要验证银、铁、锌的活动性顺序,某同学已经选择了打磨过的铁丝,他还需要的另外两种溶液是硝酸银、硫酸锌;
(2))①由溶解度曲线可知,t1℃时,A和B的溶解度大小关系是B>A;
②将饱和溶液转变成不饱和溶液可采取加入水的方法;
③由t2℃时,A的溶解度为25g可知,在t2℃时,向50g水中加入20g的A物质得到的溶液为饱和溶液,饱和溶液的溶质的质量分数是: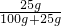 ×100%=20%;
×100%=20%;
④由于A的溶解度受温度影响变化大,B的溶解度受温度影响变化小,所以我们在A中混有少量的B时,可用冷却热饱和溶液的方法来分离A.
故答为:(1)C,A,Fe+2HCl=FeCl2+H2↑,置换反应,硝酸银、硫酸锌;(2)①B>A;②加入水;③20%,④冷却热饱和溶液.
分析:(1)根据金属冶炼的难易程度与金属活动性的关系分析大规模被使用的先后顺序;废钢铁的回收利用可以节约金属资源;生锈的铁制品放入盛有过量稀盐酸的洗槽中,首先是铁制品表面的锈与盐酸反应,当锈反应完,里面的铁与盐酸反应.若要验证三种的活动性顺序,可以用中间金属与两边金属的盐溶液反应来进行比较;
(2)①根据溶解度曲线,可以比较某温度时,不同物质溶解度的大小;
②根据饱和溶液变和不饱和溶液的转变关系分析;
③根据溶解度进行分析计算;
④根据溶解度随温度变化的情况分析分离混合物的方法.
点评:金属活动性顺序及应用是初中化学的难重点,也是考查的热点,特别指出的是金属活动性顺序的判定方法,一是通过金属与盐反应,二是通过金属与酸反应.
(2))①由溶解度曲线可知,t1℃时,A和B的溶解度大小关系是B>A;
②将饱和溶液转变成不饱和溶液可采取加入水的方法;
③由t2℃时,A的溶解度为25g可知,在t2℃时,向50g水中加入20g的A物质得到的溶液为饱和溶液,饱和溶液的溶质的质量分数是:
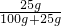 ×100%=20%;
×100%=20%;④由于A的溶解度受温度影响变化大,B的溶解度受温度影响变化小,所以我们在A中混有少量的B时,可用冷却热饱和溶液的方法来分离A.
故答为:(1)C,A,Fe+2HCl=FeCl2+H2↑,置换反应,硝酸银、硫酸锌;(2)①B>A;②加入水;③20%,④冷却热饱和溶液.
分析:(1)根据金属冶炼的难易程度与金属活动性的关系分析大规模被使用的先后顺序;废钢铁的回收利用可以节约金属资源;生锈的铁制品放入盛有过量稀盐酸的洗槽中,首先是铁制品表面的锈与盐酸反应,当锈反应完,里面的铁与盐酸反应.若要验证三种的活动性顺序,可以用中间金属与两边金属的盐溶液反应来进行比较;
(2)①根据溶解度曲线,可以比较某温度时,不同物质溶解度的大小;
②根据饱和溶液变和不饱和溶液的转变关系分析;
③根据溶解度进行分析计算;
④根据溶解度随温度变化的情况分析分离混合物的方法.
点评:金属活动性顺序及应用是初中化学的难重点,也是考查的热点,特别指出的是金属活动性顺序的判定方法,一是通过金属与盐反应,二是通过金属与酸反应.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 (2012?宿迁)(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母)
(2012?宿迁)(1)下列三种金属被发现、使用的先后顺序为:铜、铁、铝.金属大规模被使用的先后顺序跟(选填字母) B、
B、 C、
C、 D、
D、