��Ŀ����
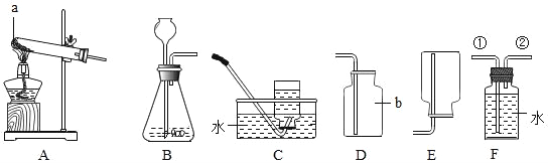
����Ŀ��ijУ��ѧ��ȤС������ͼ��ʾװ�ã�����̼��̼����������й�����̽����
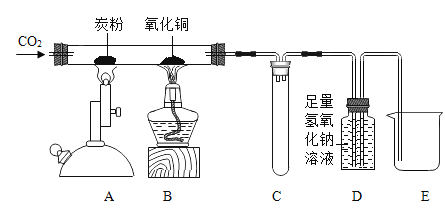
���������ϣ�ʵ���ҳ�������������Һ���ն�����̼���塣
(1)�ڼ���ҩƷǰ������Ӧ_______________��
(2)�����ͨ�������̼���壬����A�����ȵ�̿�ۣ�������_____________���ѧʽ�����÷�Ӧ��̼����Ϊ_______________��ѡ������ԡ���ԭ�ԡ�����
(3)һ��ʱ���B����ʵ������Ϊ___________��������Ӧ�Ļ�ѧ����ʽΪ_____________��
(4)ʵ���У�װ��D�е���Һ�������ձ�E�У�װ��D�ڱ�ʵ���е�����Ϊ����_______����_________��
���𰸡����װ�õ������� CO ��ԭ�� ��ɫ��ĩ������ɺ�ɫ CO+CuO![]() Cu+CO2 ���ն�����̼���� �ռ�һ����̼
Cu+CO2 ���ն�����̼���� �ռ�һ����̼
��������
���⿼�����һ����̼�Ͷ�����̼���ת����
(1)�ڼ���ҩƷǰ������Ӧ���װ�õ������ԣ��Է����ɵ�����©����
(2)������̼���������ȵ�̿�ۻᷢ����Ӧ��������һ����̼���壬��ѧʽΪCO���ڸ÷�Ӧ��̼�õ�������������������������Ӧ�����л�ԭ�ԡ�
(3)��B���У�һ����̼������ͭ��Ӧ������ͭ�Ͷ�����̼��ʵ������Ϊ��ɫ��ĩ������ɺ�ɫ��������Ӧ�Ļ�ѧ����ʽΪCO+CuO![]() Cu+CO2��
Cu+CO2��
(4)װ��D��װ��������������Һ������������Һ�������̼��Ӧ��������һ����̼��Ӧ�����ԣ�װ��D�ڱ�ʵ���е������Т����ն�����̼���壬���ռ�һ����̼��

 ���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д�
���Ͱ�ͨ�������Сѧ��ʱͬ�����ϵ�д� ���Ͱ�ͨ������ϵ�д�
���Ͱ�ͨ������ϵ�д� �ٷ�ѧ����ҵ��������ϵ�д�
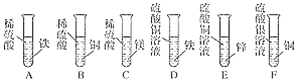
�ٷ�ѧ����ҵ��������ϵ�д�����Ŀ������ʵ����������У�С��ͬѧ��������ϡ���ᷴӦʱ�����м��뼸������ͭ��Һ��������Ƭ����������������������죬�Դ�����������Ȥ��
��������⣩����ͭ��Һ�Dz��Ǵ˷�Ӧ�Ĵ���?����ͭ��Һ������Դ�ʵ����Ӱ����?
����Ʋ�ʵ�飩�����£�С�����������������ͬ�Ѵ�ĥ����Ƭ�ֱ���뵽6��30mL10%ϡ�����У�����ÿ���м��벻ͬ���������ͭ������Һ����¼�����ͬ���������ʱ�䣬�Ӷ�ȷ���������������ʡ�
ʵ������Һ | 1 | 2 | 3 | 4 | 5 | 6 |
��������ͭ��Һ/mL | 0 | 0.5 | 2.5 | 5 | 10 | 20 |
ˮ/mL | 20 | 19.5 | 17.5 | V | 10 | 0 |
��1�����������V=____________��
��2��д������ϡ���ᷴӦ�Ļ�ѧ����ʽ____________:
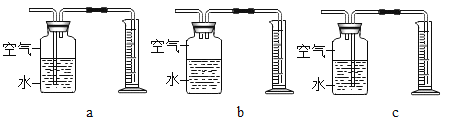
��3�������ռ��������������ͼ____________����д��ĸ��ţ�װ�á�
��ʵ��������������ͭ��Һ��������ӣ����������������ȼӿ�����Լ���������Ƭ���渽�ŵĺ�ɫ���������ӡ�
����������ͣ�
��4����������ͭ��������ӣ���Ӧ�������Ա������ܵ�ԭ����____________��
��5������ʵ������С����Ϊ����ͭ��Һ���Ǵ˷�Ӧ�Ĵ�������ԭ����____________��
��ʵ�鷴˼����������ϡ���ᷴӦ���ʻ����Բ�ȡ�Ĵ�ʩ�ǣ�д��һ�㣩____________
������ȷ�ش�����С�⽱��4�֣���ѧ�Ծ�������60�֣�
��ʵ����չ����������ʵ��,С����Ϊ�����еĽ�������Ӱ��������ϡ����ķ�Ӧ����;Ϊ���о���ͬ�������ӶԷ�Ӧ��Ӱ��,С��ͬѧ����ʵ��,ȡ�����������ͬ����Ƭ��30mL10%ϡ�����Ϻ���벻ͬ������Һ,ʵ������������Ӻ�Խ��,������Ӧ����Խ�죩:
ʵ��1 | ʵ��2 | ʵ��3 | ʵ��4 | ʵ��5 | |
�����Լ�0.5mL | ˮ | 5%NaCl��Һ | 5%Mg��NO3��2��Һ | 5%FeSO4��Һ | 5%CuSO4��Һ |
������������ | + | + | + | ++ | +++ |
��6������У���ˮ����ʵ���Ŀ��___��
��7������ʵ����ƴ���ȱ�ݣ���ȱ����___��ʵ��Ľ����η����ϱ��е�ʵ�����ɵõ���ʵ������ǣ���____________����____________.