题目内容
为了测定实验室中高锰酸钾样品的纯度(杂质不参加反应),取16g该样品加热,完全反应后,得到1.6g氧气,求样品中高锰酸钾的质量.分析:根据高锰酸钾受热分解的化学方程式,可得知反应中高锰酸钾与氧气的质量关系,再由生成氧气的质量即可计算所需要高锰酸钾的质量.
解答:解:设样品中含高锰酸钾的质量为x.
2KMnO4
K2MnO4+MnO2+O2↑
2×158 32
x 1.6g
=
x=15.8g
答:样品中高锰酸钾的质量为15.8g.
故答案为:15.8g.
2KMnO4
| ||
2×158 32
x 1.6g
| 2×158 |
| x |
| 32 |
| 1.6g |
x=15.8g
答:样品中高锰酸钾的质量为15.8g.
故答案为:15.8g.
点评:本题为根据化学方程式计算类问题中的基础计算,完整的计算步骤、规律的书写格式是解答此类问题时需要留意的地方.

练习册系列答案
相关题目
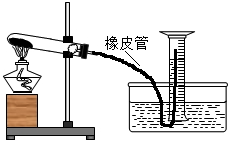 (2013?衢州)如图所示,为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),小衢称取4.0g该样品于试管中加热,用量筒收集生成的气体.高锰酸钾完全分解后,移去酒精灯.待装置冷却到室温后,得到0.23升氧气(常温下氧气的密度约为1.4克/升).
(2013?衢州)如图所示,为了测定实验室中高锰酸钾样品的纯度(假设杂质不参加反应),小衢称取4.0g该样品于试管中加热,用量筒收集生成的气体.高锰酸钾完全分解后,移去酒精灯.待装置冷却到室温后,得到0.23升氧气(常温下氧气的密度约为1.4克/升).