题目内容
(2012?常熟市模拟)某化工厂为综合利用生产过程中的CaSO4,设计了以下制备(NH4)2SO4的工艺流程:(部分反应条件省略)
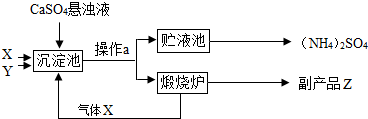
(1)上述流程中,气体X为
(2)操作a的名称是
(3)写出硫酸铵在农业上的一个用途

(1)上述流程中,气体X为
CO2
CO2
,气体Y为NH3
NH3
,副产品Z为CaO
CaO
.(2)操作a的名称是
过滤
过滤
,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需要漏斗
漏斗
.(3)写出硫酸铵在农业上的一个用途
化肥或氮肥
化肥或氮肥
.分析:(1)依据X是煅烧炉生成同时得到Z可推测该煅烧炉内的物质是碳酸钙;因为最后生成硫酸铵可推测Y是氨气,依据关于煅烧炉内物质的推测可知该副产品的组成.
(2)依据操作a是分离液体与固体混合物的操作,对相关问题进行分析即可.
(3)根据硫酸铵属于氮肥可知其用途.
(2)依据操作a是分离液体与固体混合物的操作,对相关问题进行分析即可.
(3)根据硫酸铵属于氮肥可知其用途.
解答:解:(1)依据X是煅烧炉生成同时得到Z可推测该煅烧炉内的物质是碳酸钙;碳酸钙高温可生成二氧化碳你和氧化钙,所以X是二氧化碳,Z是氧化钙,因为最后生成硫酸铵可推测知Y是氨气;
(2)操作a是分离液体与固体混合物的操作,是过滤操作,该操作用到的玻璃仪器除去除玻璃棒、烧杯外,漏斗也是必不可少的玻璃仪器.
(3)因为硫酸铵属于铵盐是农业中常用的氮肥.
故答案为:(1)CO2;NH3;CaO;(2)过滤;漏斗;(3)化肥或氮肥.
(2)操作a是分离液体与固体混合物的操作,是过滤操作,该操作用到的玻璃仪器除去除玻璃棒、烧杯外,漏斗也是必不可少的玻璃仪器.
(3)因为硫酸铵属于铵盐是农业中常用的氮肥.
故答案为:(1)CO2;NH3;CaO;(2)过滤;漏斗;(3)化肥或氮肥.
点评:做推断题时要充分利用所给的信息,结合自己已学过的知识,进行有依据性的推测,只有这样才能顺利解题.

练习册系列答案
相关题目