题目内容
过氧化钠(Na2O2)是一种黄色固体.某次科技活动中,某化学兴趣小组的同学将包有Na2O2固体的棉花放入如图1烧杯中,缓慢倒入CO2后发现处于下位的蜡烛先熄灭,上位的后熄灭,同时也惊奇的发现棉花燃烧起来.
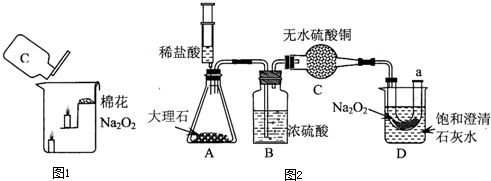
Ⅰ.实验过程
“下位的蜡烛先熄灭,上位的后熄灭”的现象说明二氧化碳具有
Ⅱ.棉花为什么会燃烧呢?小组同学联想起物质燃烧的相关知识,推理出棉花要燃烧,除了满足“棉花是可燃物”这一条件还需满足的条件是
提出问题:在实验中是如何给棉花燃烧提供上述条件的呢?
查阅资料:(1)在常温下Na2O2和CO2能发生化学反应.
(2)Na2O2和H2O能发生化学反应生成O2
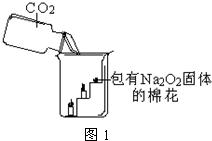
设计实验:经过讨论后,小组同学设计了如图2的实验进行探究.
实验步骤:
(1)按上图装配好装置,并检查其气密性;
(2)将相关的试剂加入对应的仪器中;
(3)推动注射器的活塞,把稀盐酸注入锥形瓶内,并固定活塞位置;
(4)一段时间后,在a处放置一根带火星的小木条,观察现象.
实验现象:
(1)干燥管中没有出现蓝色;
(2)带火星的小木条复燃;
(3)饱和的澄清石灰水变浑浊.
实验分析:
(1)D装置的烧杯内变浑浊的原因是
(2)B装置的作用是
实验结论:
(1)“小木条复燃”说明了Na2O2和CO2反应产生了
(2)“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应

Ⅰ.实验过程
“下位的蜡烛先熄灭,上位的后熄灭”的现象说明二氧化碳具有
密度比空气大,不可燃烧且不支持燃烧
密度比空气大,不可燃烧且不支持燃烧
的性质.Ⅱ.棉花为什么会燃烧呢?小组同学联想起物质燃烧的相关知识,推理出棉花要燃烧,除了满足“棉花是可燃物”这一条件还需满足的条件是
与氧气接触,温度达到着火点
与氧气接触,温度达到着火点
.提出问题:在实验中是如何给棉花燃烧提供上述条件的呢?
查阅资料:(1)在常温下Na2O2和CO2能发生化学反应.
(2)Na2O2和H2O能发生化学反应生成O2
设计实验:经过讨论后,小组同学设计了如图2的实验进行探究.
实验步骤:
(1)按上图装配好装置,并检查其气密性;
(2)将相关的试剂加入对应的仪器中;
(3)推动注射器的活塞,把稀盐酸注入锥形瓶内,并固定活塞位置;
(4)一段时间后,在a处放置一根带火星的小木条,观察现象.
实验现象:
(1)干燥管中没有出现蓝色;
(2)带火星的小木条复燃;
(3)饱和的澄清石灰水变浑浊.
实验分析:
(1)D装置的烧杯内变浑浊的原因是
Na2O2与CO2反应放出热量,使氢氧化钙溶液温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体
Na2O2与CO2反应放出热量,使氢氧化钙溶液温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体
;(2)B装置的作用是
除去CO2中混有的水蒸气(或干燥气体)
除去CO2中混有的水蒸气(或干燥气体)
;C装置的作用是检验水蒸气是否除尽
检验水蒸气是否除尽
.实验结论:
(1)“小木条复燃”说明了Na2O2和CO2反应产生了
氧气(O2)
氧气(O2)
;(2)“饱和的澄清石灰水变浑浊”说明Na2O2和CO2反应
放出热量
放出热量
,使棉花满足另一燃烧条件.分析:Ⅰ.实验过程:
二氧化碳灭火的原因:①二氧化碳的密度比空气大;②二氧化碳不能燃烧也不支持燃烧;
Ⅱ.可燃物燃烧的条件是:①与氧气接触;②达到可燃物的着火点;
实验分析:
(1)大多数的固体物质的溶解度随着温度的升高而增大,而氢氧化钙的溶解度却随着温度升高而减小;
(2)浓硫酸具有吸水性,常用来干燥气体,硫酸铜遇水变蓝,常用来检验是否含有水蒸气;
实验结论:
(1)氧气能使带火星的木条复燃;
(2)据石灰水变浑浊可知溶液温度升高,Na2O2和CO2反应放热.
二氧化碳灭火的原因:①二氧化碳的密度比空气大;②二氧化碳不能燃烧也不支持燃烧;
Ⅱ.可燃物燃烧的条件是:①与氧气接触;②达到可燃物的着火点;
实验分析:
(1)大多数的固体物质的溶解度随着温度的升高而增大,而氢氧化钙的溶解度却随着温度升高而减小;
(2)浓硫酸具有吸水性,常用来干燥气体,硫酸铜遇水变蓝,常用来检验是否含有水蒸气;
实验结论:
(1)氧气能使带火星的木条复燃;
(2)据石灰水变浑浊可知溶液温度升高,Na2O2和CO2反应放热.
解答:解:Ⅰ.实验过程:
向烧杯中倒入二氧化碳,下面的蜡烛先熄灭,上面的蜡烛后熄灭,说明二氧化碳的密度比空气的密度大;二氧化碳接触火焰,没有燃烧起来,说明不能燃烧;蜡烛熄灭了,说明不能支持燃烧;
Ⅱ、物质燃烧需要三个条件:①物质是可燃物②与氧气接触③温度达到着火点.棉花是可燃物,还需要满足与氧气接触,温度达到着火点;
实验分析:(1)从图1我们知道,Na2O2和CO2能发生反应,产生氧气,并放出了热量,棉花因有热量使温度达到着火点,就燃烧了起来.在图2中,Na2O2和CO2发生反应,放出热量使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体,从而使澄清石灰水变浑浊;
(2)B装置的作用是除去CO2中混有的水蒸气(或干燥气体),防止与Na2O2反应生成氧气,造成干扰;C装置的作用是检验水蒸气是否除尽;
实验结论:
(1)“小木条复燃”说明了Na2O2和CO2反应产生了氧气;
(2)石灰水变浑浊可知溶液温度升高,进一步上面Na2O2和CO2反应放热;
故答案为:
Ⅰ.密度比空气大,不可燃烧且不支持燃烧;
Ⅱ.与氧气接触,温度达到着火点;
实验分析:(1)Na2O2与CO2反应放出热量,使氢氧化钙溶液温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体;
(2)除去CO2中混有的水蒸气(或干燥);检验水蒸气是否除尽;
实验结论:(1)氧气(O2); (2)放出热量.
向烧杯中倒入二氧化碳,下面的蜡烛先熄灭,上面的蜡烛后熄灭,说明二氧化碳的密度比空气的密度大;二氧化碳接触火焰,没有燃烧起来,说明不能燃烧;蜡烛熄灭了,说明不能支持燃烧;
Ⅱ、物质燃烧需要三个条件:①物质是可燃物②与氧气接触③温度达到着火点.棉花是可燃物,还需要满足与氧气接触,温度达到着火点;
实验分析:(1)从图1我们知道,Na2O2和CO2能发生反应,产生氧气,并放出了热量,棉花因有热量使温度达到着火点,就燃烧了起来.在图2中,Na2O2和CO2发生反应,放出热量使石灰水温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体,从而使澄清石灰水变浑浊;
(2)B装置的作用是除去CO2中混有的水蒸气(或干燥气体),防止与Na2O2反应生成氧气,造成干扰;C装置的作用是检验水蒸气是否除尽;
实验结论:
(1)“小木条复燃”说明了Na2O2和CO2反应产生了氧气;
(2)石灰水变浑浊可知溶液温度升高,进一步上面Na2O2和CO2反应放热;
故答案为:
Ⅰ.密度比空气大,不可燃烧且不支持燃烧;
Ⅱ.与氧气接触,温度达到着火点;
实验分析:(1)Na2O2与CO2反应放出热量,使氢氧化钙溶液温度升高,氢氧化钙的溶解度减小,析出氢氧化钙固体;
(2)除去CO2中混有的水蒸气(或干燥);检验水蒸气是否除尽;
实验结论:(1)氧气(O2); (2)放出热量.
点评:本题考查内容相对综合,涉及到的知识点有二氧化碳的性质、燃烧的条件、固体物质溶解度影响因素等,主要是运用基础知识去解决新的信息问题,这就要求学生学以致用,综合分析考虑.

练习册系列答案
相关题目


 23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
23、呼吸面具和潜水艇中可用过氧化钠(Na2O2)作为供氧剂.下面是兴趣小组同学围绕过氧化钠进行的一系列探究,请你参与到其中.
