题目内容
【题目】实验室常用的干燥剂“碱石灰”是CaO和固体NaOH的混合物,极易与空气中水蒸汽和CO_2反应而变质.某同学对一瓶久置的“碱石灰”作了如下探究:
(1)猜想:
猜想I:没有变质,“碱石灰”只含有CaO、固体NaOH;
猜想II:已完全变质,“碱石灰”全部变成了CaCO3和Na2CO3.
则CaO与水反应的反应方程式为________.
(2)实验:如图所示:
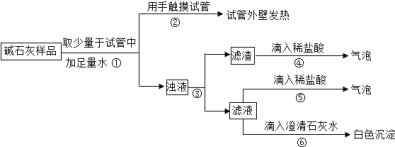
(3)判断:
a.若Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,则由操作②现象判断:猜想II________(填:成立、不成立)
b.操作④发生化学反应的方程式为________;由操作⑤⑥的现象判断:滤液中含有________(写化学式);由此判断猜想I________(填:成立、不成立).
c.综合a和b的结论,判断该样品变质情况为________.
(4)拓展:由上述实验说明,实验室中“碱石灰”应________保存;操作③中玻棒的作用是________.
【答案】CaO+H2O=Ca(OH)2 不成立CaCO3+2HCl=CaCl2+CO2↑+H2ONa2CO3不成立部分变质密封引流(或导流),防止溶液外溅
【解析】
(1)氧化钙和水反应生成氢氧化钙,反应方程式为:CaO+H2O═Ca(OH)2;
(3)a、Ca(OH)2、CaCO3和Na2CO3投入到水中不会放热,而样品加水溶解时试管发热,说明猜想II不成立;
b、根据题中的阳离子结合可能的变质,会生成沉淀的只有钙离子形成的碳酸钙沉淀,碳酸钙和盐酸反应生成氯化钙、水和二氧化碳,反应方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O;
滤液加盐酸会生成气体,加氢氧化钙会生成白色沉淀,说明含有滤液中碳酸根离子,金属阳离子是由钠离子,所以滤液中含有碳酸钠;
(4)碱石灰在空气中极易变质,所以需要密封保存,过滤时,液体可能外溅,需要玻璃棒的引流。