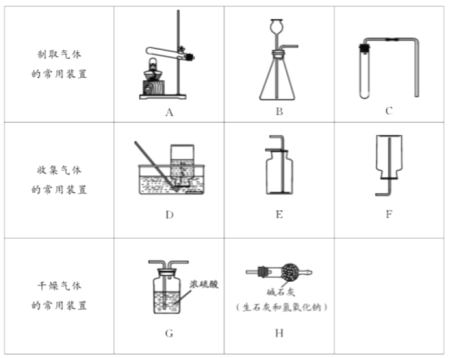
题目内容
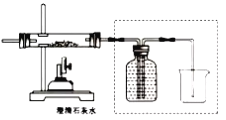
【题目】为了测定某含杂质7%的黄铜样品中铜的质量分数(杂质中不含铜、锌元素,杂质不溶于水,不与其它物质反应,受热也不分解),某化学小组进行了如下实验:

(1)配制上述质量分数为14.6%的稀盐酸,需要质量分数为36.5%的浓盐酸的质量是 _______.
(2)发生反应的化学方程式为________.
(3)根据已知条件列出求解100g该黄铜样品中锌的质量(X)的比例式为________.
(4)该黄铜样品中铜的质量分数是________ .
(5)向过滤后所得滤液中加入87.4g水,则最终所得溶液之中溶质的质量分数是 ________ .
(6)欲将黄铜样品中的铜转化为铜盐,可将过滤后所得的不溶性物质洗涤、烘干.然后在空气中加热,充分反应,则可得到含杂质的氧化铜的质量是_______,再经过某些反应操作就得到了所需铜盐.
【答案】40gZn+2HCl═ZnCl2+H2↑![]() =
=![]() 80%13.6%107g
80%13.6%107g
【解析】
(1)设需要质量分数为36.5%的浓盐酸的质量是x,100g×14.6%=x×36.5%,解得:x=40g;
(2)铜不能和稀盐酸反应,锌和稀盐酸反应生成了氯化锌和氢气,该反应的化学方程式为:Zn+2HCl═ZnCl2+H2↑;
(3)反应生成氢气的质量为:100g+100g-199.6g=0.4g,设合金中锌的质量为x,反应生成氯化锌的质量为y,
Zn+2HCl═ZnCl2+H2↑
65 136 2
x y 0.4g
![]() x=13g,
x=13g,
![]() y=27.2g,
y=27.2g,
(4)该黄铜样品中铜的质量分数是![]() ×100%=80%;
×100%=80%;
(5)最终所得溶液中溶质的质量分数为:![]() ×100%=13.6%;
×100%=13.6%;
(6)铜锌合金中铜的质量为:100g×(1-7%)-13g=80g,设80g铜和氧气反应能够生成氧化铜的质量为a,
2Cu+O2![]() 2CuO
2CuO
128 160
80g a
![]()
a=100g,
所以可以得到含杂质的氧化铜的质量为:100g+100g×7%=107g。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
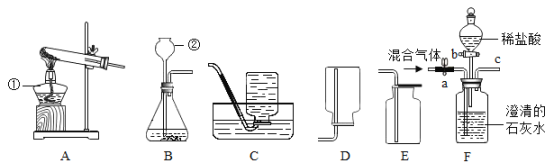
小博士期末闯关100分系列答案【题目】某化学活动小组在一次实验中进行如下图所示实验:
此时双察到U型管左右两侧产生的現象分別是__________:实验后,小組同学充分振荡U型管,发现管内仍有白色固体残留,将混合物过滤后,同学们对滤液成分产生了浓厚的兴趣,于是进行了进一歩的探究活动。
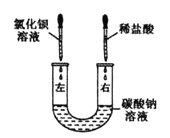
[提出向題]:滤液中可能含有哪些溶质?
[猜想与假设]:猜想一:溶质为NaC1
猜想二:溶质为NaC1和![]()
猜想三:溶质为NaC1、![]() 和 HCl
和 HCl
[评价与交流]:你认为以上猜想_________不合理,理由是_______________:
则你的猜想为_______________:
[实验探究]:小红为了验证滤液成分,取滤液于试管中,向其中滴加少量的硫酸钠溶液,观察到无明显现象。由此得出结论:猜想一成立。小刚认为小红的结论不严密,因为_____。
为验证你的猜想请填写下表:
实验过程 | 实验现象 | 实验结论 |
________ | ________ | 你的猜想成立 |
(归纳与总结]:通过上述实验我们能够总结出:在确定化学反应后所得溶液中溶质成分时,除了考虑生成物外,还要考虑________。
【题目】某校化学兴趣小组在学习了催化剂的知识后,想探究氧化铜能否在过氧化氢溶液分解反应中起到催化作用。请你一起参与他们的探究过程,并填写下列空白。
(问题)CuO能不能作过氧化氢溶液分解反应的催化剂呢?
(猜想)____________。
(实验验证)
实验 | 实验步骤 | 实验现象 | 实验结论 |
实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | ________ | 常温下H2O2溶液分解速率非常缓慢,放出很少量氧气 |
实验二 | 在装有H2O2溶液的试管中加入少量的CuO,然后将带火星的木条伸入试管中 | 有较多气泡产生,木条复燃 | ____________ |
(讨论与反思)经过讨论,有的同学认为只有上述两个实验,不能证明CuO能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验。
实验三:
(实验目的)探究_____________。
(实验步骤)①准确称量CuO(少量)的质量;
②重复实验二的步骤;待反应结束,将试管里的物质过滤,洗涤,干燥,称量;
③对比反应前后CuO的质量。
(讨论)如果_______________,则说明CuO能作过氧化氢溶液分解反应的催化剂。
但小华认为,要证明猜想,上述三个实验还不足以说明,还需要再增加一个实验。
(实验目的)________________。
(实验结论)CuO能作过氧化氢溶液分解反应的催化剂,请写出CuO催化过氧化氢分解的文字表达式:
_______________。
(拓展探究)同种催化剂,还有哪些因素会影响过氧化氢分解反应的催化效果?
假设:________________。
【题目】溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
①下表是KNO3、NaCI在不同温度下的溶解度(单位:g/100g水).
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCI | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
Ⅰ.上表中的两种物质在40℃时,________的溶解度较大;请用相应的数据列式表示该温度时KNO3饱和溶液的质量分数________ (不要求计算).
Ⅱ.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法________ .
Ⅲ.20℃时,将20g NaCl放入50g水中,所得溶液的质量是________ g.
Ⅳ.从NaCl溶液中得到NaCl晶体的方法是________ .
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).
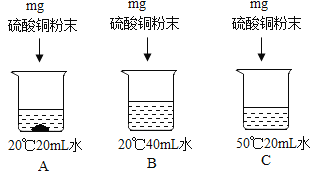
所得三个溶液中:一定属于饱和溶液的是________ ,溶液中溶剂质量的大小关系是________ .