题目内容
(2011?密云县二模)金属是人类社会生存和发展不可缺少的物质.(1)人类使用过的金属材料中,铁常用于制作炊具,是利用了铁的性.
(2)钢铁又被称为工业的骨骼,工业上用一氧化碳还原含氧化铁的赤铁矿石得到生铁,该过程用化学方程式表示为.石油与钢铁有类似美誉,被称为工业的血液.石油、煤和总称为化石燃料
(3)某金属冶炼厂的管道烟泥中含有某些单质,其中Cu约占10.3%、Zn约占5.0%、S约占1.2%.现欲回收铜和锌,并对硫进行环保处理,主要步骤如图所示:
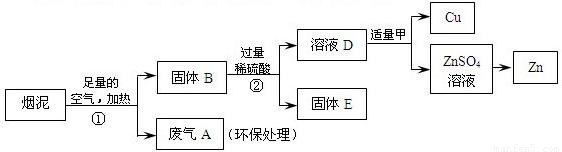
a.步骤①产生的废气A中,一定含有的有害气体是.
b.溶液D中一定含有的溶质是.
c.有人认为若步骤①中空气不足量,会导致锌的回收率降低,请你谈谈是否正确并说明理由?.

【答案】分析:(1)金属的硬度一般比较大,具有良好的导电性、导热性、延展性等;导热性
(2)根据反应物和生成物及其质量守恒定律可以书写化学方程式;三大化石燃料是指煤、石油、天然气
(3)a、因为烟泥中含有硫的单质,故加热后会生成有毒气体二氧化硫.
b、由于固体B中含有氧化锌与氧化铜,所以和硫酸反应会生成硫酸铜及硫酸锌两种新的溶质.
c、空气量不足不会影响锌的回收,因为不管锌在第一步中是否被氧化,在第二步中都会完全转化为硫酸锌,不会影响锌的回收.
解答:解:(1)利用铁制作炊具是利用了铁的良好的导热性.故答案为:导热性.
(2)氧化铁和一氧化碳反应的化学方程式为:3CO+Fe2O3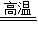 2Fe+3CO2.三大化石燃料是指煤、石油、天然气
2Fe+3CO2.三大化石燃料是指煤、石油、天然气
故答案为:3CO+Fe2O3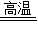 2Fe+3CO2 天然气
2Fe+3CO2 天然气
(3)a、烟泥中存在单质硫,在空气中加热时会产生二氧化硫,二氧化硫是常见的空气污染物.
故答案为:SO2
b、固体B中含有氧化锌与氧化铜,两者均能和硫酸反应,生成硫酸铜及硫酸锌两种新的溶质,由于反应中硫酸过量所以溶液中还存在剩余的硫酸.故答案为:ZnSO4、CuSO4、H2SO4
c、有分离过程可以看出,不管锌在第一步中是否被完全氧化,在第二步中都会完全转化为硫酸锌,也就是最终锌完全转化为硫酸锌,因而不会影响锌的回收.
故答案为:不正确;金属锌也可以直接和稀硫酸反应.
点评:本题主要考查的知识点有金属的性质、化学方程式的书写,解答时要根据质量守恒定律来正确地书写化学方程式.此题也是对物质分离与提纯的知识的考查,解决的重点是对每一步具体的反应做出详细的分析与判断.
(2)根据反应物和生成物及其质量守恒定律可以书写化学方程式;三大化石燃料是指煤、石油、天然气
(3)a、因为烟泥中含有硫的单质,故加热后会生成有毒气体二氧化硫.
b、由于固体B中含有氧化锌与氧化铜,所以和硫酸反应会生成硫酸铜及硫酸锌两种新的溶质.
c、空气量不足不会影响锌的回收,因为不管锌在第一步中是否被氧化,在第二步中都会完全转化为硫酸锌,不会影响锌的回收.
解答:解:(1)利用铁制作炊具是利用了铁的良好的导热性.故答案为:导热性.
(2)氧化铁和一氧化碳反应的化学方程式为:3CO+Fe2O3
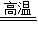 2Fe+3CO2.三大化石燃料是指煤、石油、天然气
2Fe+3CO2.三大化石燃料是指煤、石油、天然气故答案为:3CO+Fe2O3
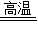 2Fe+3CO2 天然气
2Fe+3CO2 天然气(3)a、烟泥中存在单质硫,在空气中加热时会产生二氧化硫,二氧化硫是常见的空气污染物.
故答案为:SO2
b、固体B中含有氧化锌与氧化铜,两者均能和硫酸反应,生成硫酸铜及硫酸锌两种新的溶质,由于反应中硫酸过量所以溶液中还存在剩余的硫酸.故答案为:ZnSO4、CuSO4、H2SO4
c、有分离过程可以看出,不管锌在第一步中是否被完全氧化,在第二步中都会完全转化为硫酸锌,也就是最终锌完全转化为硫酸锌,因而不会影响锌的回收.
故答案为:不正确;金属锌也可以直接和稀硫酸反应.
点评:本题主要考查的知识点有金属的性质、化学方程式的书写,解答时要根据质量守恒定律来正确地书写化学方程式.此题也是对物质分离与提纯的知识的考查,解决的重点是对每一步具体的反应做出详细的分析与判断.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
 4Al+3R↑.
4Al+3R↑.