题目内容
实验室获取氮气有很多种途径,常见的3种方法是:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通入灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.
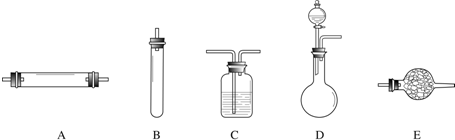
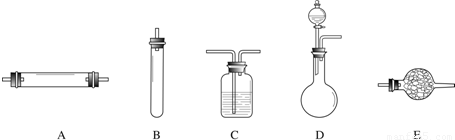
进行实验时可选择的实验仪器如图(省略夹持装置与加热装置)
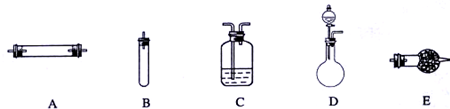
(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最后选用
(2)方法二:为保证所得氨气尽可能纯净,除了使用铜外,还可以向装置
(3)方法三:制氨气的化学方程式为:
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂,在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
方法一:将氨气通入灼热的氧化铜粉末,得到纯净的氮气和铜;
方法二:将空气通入灼热的铜,得到较纯净的氮气和氧化铜粉末;
方法三:将亚硝酸钠(NaNO2)和氯化铵的混合溶液加热,氮元素全部转化为氮气.
进行实验时可选择的实验仪器如图(省略夹持装置与加热装置)

(1)方法一:制氮气所需的氨气可以用浓氨水滴加到生石灰中得到,此反应的发生装置最后选用
D
D
(填装置编号).请写出生石灰在此反应中的两个作用:生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度)
生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度)
,生石灰与水反应,减少了溶剂
生石灰与水反应,减少了溶剂
.(2)方法二:为保证所得氨气尽可能纯净,除了使用铜外,还可以向装置
E
E
(选填装置编号)中加入碱石灰
碱石灰
以除去其他杂志气体.(3)方法三:制氨气的化学方程式为:
NaNO2+NH4Cl
NaCl+N2↑+2H2O
| ||
NaNO2+NH4Cl
NaCl+N2↑+2H2O
.
| ||
(4)绿色化学是指在制造和应用化学产品时应有效利用(最好可再生)原料,消除废物和避免使用有毒的和危险的试剂与溶剂,在制取氮气的3种方法中,联合使用方法一和方法二与单独使用方法三相比,具有很多优越性,请从绿色化学的角度进行评价:
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染)
.分析:(1)根据反应物状态和反应条件选择发生装置,对比原料及生产过程分析生石灰的作用:生石灰和水反应生成熟石灰,一方面消耗氨水中的水,另一方面放出的热量促使氨水挥发、分解而得到氨气;
(2)根据实验的要求要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂完成;
(3)根据反应物及题目的信息结合元素守恒判断生成物写出化学方程式;
(4)根据绿色化学的定义结合反应的原理对比分析优点.
(2)根据实验的要求要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂完成;
(3)根据反应物及题目的信息结合元素守恒判断生成物写出化学方程式;
(4)根据绿色化学的定义结合反应的原理对比分析优点.
解答:解:(1)用CaO和浓氨水反应,应选固液常温型的发生装置,即D;浓氨水常温下跟生石灰反应生成氨气和氢氧化钙,化学方程式为CaO+NH3?H2O=NH3↑+Ca(OH)2,因为氨水不稳定易挥发,生石灰和水反应生成熟石灰的过程中,生石灰的两个作用是:一方面消耗氨水溶液中的水,另一方面放出的热量促使氨水挥发、分解而得到氨气;
(2)空气中除了氮气、氧气外,还含有二氧化碳、水蒸气等,为保证所得氨气尽可能纯净,要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂-碱石灰,既可以吸收二氧化碳又能吸收水;
(3)根据信息反应物是亚硝酸钠(NaNO2)和氯化铵,反应条件是加热,氮元素全部转化为氮气,反应前后元素的种类不变,因此生成物还有氯化钠和水,因此反应的方程式为:
NaNO2+NH4Cl
NaCl+N2↑+2H2O;
(4)从题中信息可知,NH3和CuO生成Cu和N2 而空气和Cu生成CuO,故Cu和CuO可以循环使用,方法三使用有毒的亚硝酸钠,方法一和二避免使用有毒物质而造成污染,因此联合使用方法一和方法二与单独使用方法三相比的优点有:铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染).
故答案为:(1)D; 生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度);生石灰与水反应,减少了溶剂;
(2)E;碱石灰; (3)NaNO2+NH4Cl
NaCl+N2↑+2H2O;(4)铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染).
(2)空气中除了氮气、氧气外,还含有二氧化碳、水蒸气等,为保证所得氨气尽可能纯净,要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂-碱石灰,既可以吸收二氧化碳又能吸收水;
(3)根据信息反应物是亚硝酸钠(NaNO2)和氯化铵,反应条件是加热,氮元素全部转化为氮气,反应前后元素的种类不变,因此生成物还有氯化钠和水,因此反应的方程式为:
NaNO2+NH4Cl
| ||
(4)从题中信息可知,NH3和CuO生成Cu和N2 而空气和Cu生成CuO,故Cu和CuO可以循环使用,方法三使用有毒的亚硝酸钠,方法一和二避免使用有毒物质而造成污染,因此联合使用方法一和方法二与单独使用方法三相比的优点有:铜和氧化铜可循环使用,节省试剂(或避免使用有毒物质而造成污染).
故答案为:(1)D; 生石灰和水反应放热,促使氨水挥发、分解而得到氨气(或降低氨气的溶解度);生石灰与水反应,减少了溶剂;
(2)E;碱石灰; (3)NaNO2+NH4Cl
| ||
点评:本题是一信息题,考查学生的知识拓展迁移能力,要求学生有良好的分析能力,能会从题干信息中找突破口,根据信息将学过的知识进行迁移.

练习册系列答案
相关题目