��Ŀ����
����Ŀ��ѧУ��ѧ��ȤС����ѧϰ������ѧ���ʺ���������̽��ʵ�飮
��1��С����ͭ˿������������Һ�У��÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2��С����п������һ��������������Һ�У����ַ�Ӧ����Һ����������������С�����䡱����
��3��С����˼���������ͭ����п�۵Ļ�������һ��������������Һ�У���Ӧ�Ƿ����Ⱥ�˳��̽�����£�
��������⡿ͭ����п�۵Ļ�������һ��������������Һ�У���Ӧ�Ƿ����Ⱥ�˳��
���������롿��ͭ��������������Һ��Ӧ ��п��������������Һ��Ӧ
�����ʵ�顿��С��ȡһ����ͭ�ۺ�п�۵Ļ���������������������Һ�У���Һ����ɫû�з����仯���ɴ��ƶϣ�ͭ������������Һ�����������û����������Ӧ��Ȼ������Ӧ��Ļ�����м���ϡ���ᣬ���������ݲ������ɴ��ƶϣ�п������������Һ�����������û����������Ӧ��
��С����ȡͬ�������ۺ�п�ۻ�������϶�������������Һ�У�������Һ�����ɫ���ɴ��ƶ�ͭ������������Һ�����������û����������Ӧ��
���������ó����ۡ��ۺ�����ʵ�������֪��ͭ����п�۵Ļ�������һ��������������Һ�У�п����������������Һ��Ӧ��
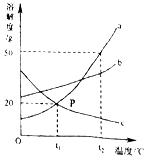
����˼��С�Ϸ����õ���ɫ��Һ������Һ�������������������ֲ��룬���������ֲ�����ܳ����������ֲ����ǣ�������Ϊ��������Ϊ ��
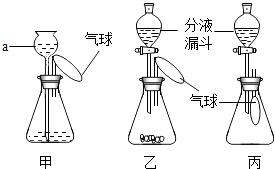
��4����̽��ʵ���Ϊ�˲ⶨijϡ�������������������ȡͭ�ۺ�п�۵Ļ����10�˷����ձ��У���ȡ60��ϡ�����6�μ����ձ��У�����ַ�Ӧ��ʵ���������£�
���� | ��1�� | ��2�� | ��3�� | ��4�� | ��5�� | ��6�� |
����ϡ�����������g�� | 10 | 10 | 10 | 10 | 10 | 10 |
ʣ���������� ��g�� | 9.35 | 8.70 | 8.05 | 7.40 | 6.75 | 6.75 |
�����ϱ��ṩ�����ݣ�������ϡ���������������
���𰸡�
��1��Cu+2AgNO3�T2Ag+Cu��NO3��2
��2����С
��3��û�У�����������������п������ͭ������п������ͭ��������
��4���Ƚϵ���κ͵����ε����ݿ���֪����ʣ������������Ϊ6.75g������˵���ù�����п������Ϊ��10g��6.75g=3.25g��
��ϡ��������������Ϊx
Zn+H2SO4�TZnSO4+H2��
65 98
3.25g x
![]()
x=4.9g
ϡ������������������Ϊ ![]() ��100%=9.8%
��100%=9.8%
���������⣺��1��ͭ����������Ӧ�ķ�Ӧ����ͭ��������������������������ͭ���ù۲취��ƽ���ɣ��仯ѧ����ʽΪCu+2AgNO3�T2Ag+Cu��NO3��2 �� ��2����пƬ������������Һ�У�п�ܰ����û��������ɷ�Ӧʱ��������ϵ��֪��ÿ65��������п���û���216�����������������Һ������������3�������ʵ�顿������ͭ����ɫ��Һ������������Һ����ɫû�з����仯���ɴ��ƶ�ͭ������������Һû�з�Ӧ��ͭ��п������ֻ��п����ϡ���ᷴӦ�������������Լ���ϡ���ᣬ���������ݲ������ƶ�ʣ������в�����п���Ӷ���˵��п�Ѿ���ȫ��Ӧ��������ͭ����ɫ��Һ���������ݿ�����Һ�����ɫ���ɴ��ƶ�ͭ������������Һ�Ѿ������˷�Ӧ������˼�����ڷ����õ���ɫ��Һ��һ����������ͭ�����Ը��������û�ԭ����Һ�к�һ����������п�������Ƿ�������������ȷ����������ʿ����Ǣ�����п������ͭ��������п������ͭ�������������Դ��ǣ�1��Cu+2AgNO3�T2Ag+Cu��NO3��2����2����С����3�������ʵ�顿��û�У��������ڷ���������˼������п������ͭ������п������ͭ������������4������ϡ�������������Ϊ9.8%��
�����㾫����������Ŀ����֪���������ý������ϵ�ѡ�����ݺ���д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ�����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���պ�ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ�������������������ע�⣺a����ƽ b������ c�����ţ�

 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�