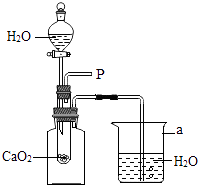
题目内容
【题目】某化学兴趣小组设计了一组“吹气球”实验,三套装置如图:
(1)甲装置:
①仪器a的名称为;
②向a中加水会看到气球胀大,一段时间内气球大小没有变化,说明该装置气密性 .
(2)乙装置:
①若生成O2使气球胀大,则锥形瓶中所装的固体物质可以是 .
②若生成H2使气球胀大,则反应的化学方程式为 .
③若锥形瓶中装有NaOH固体,分液漏斗中加入少量水,则气球胀大的主要原因是 .
(3)丙装置:
若锥形瓶中盛满CO2 , 欲使气球胀大,则分液漏斗中的液体可以是 . 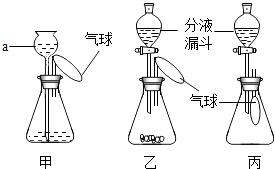
【答案】
(1)长颈漏斗;良好
(2)二氧化锰;Zn+H2SO4=ZnSO4+H2↑;NaOH固体溶于水放热,空气受热膨胀
(3)NaOH溶液
【解析】解:(1)①仪器a的名称为长颈漏斗;②向a中加水会看到气球胀大,一段时间内气球大小没有变化,说明该装置气密性良好.(2)①该装置是固液在常温下制取气体的装置,若生成O2使气球胀大,则锥形瓶中所装的固体物质可以是催化剂二氧化锰,倒入的液体是过氧化氢溶液;②锌和稀硫酸反应生成硫酸锌和氢气,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.③氢氧化钠溶于水放出大量的热,装置内气压增大,气球胀大.(3)丙中CO2气体被吸收时,装置内压强减小,内部的气球就会胀大,氢氧化钠溶液可吸收二氧化碳气体.故答案为:(1)①长颈漏斗;②良好;(2)①二氧化锰;②Zn+H2SO4=ZnSO4+H2↑;③NaOH固体溶于水放热,空气受热膨胀;(3)NaOH溶液.
(1)根据仪器的名称和检查气密性的方法进行分析;(2)根据氧气的实验室制法、氢气的实验室制法以及氢氧化钠的性质进行分析;(3)丙中CO2气体被吸收时,装置内压强减小,内部的气球就会胀大,据此分析.

【题目】学校化学兴趣小组在学习金属化学性质后,作了以下探究实验.
(1)小董将铜丝放入硝酸银溶液中,该反应的化学方程式为 .
(2)小凡将锌粒放入一定量的硝酸银溶液中,发现反应后溶液的质量(填“变大”、“变小”或“不变”).
(3)小晗在思考:如果将铜粉与锌粉的混合物放入一定量的硝酸银溶液中,反应是否有先后顺序?探究如下:
【提出问题】铜粉与锌粉的混合物放入一定量的硝酸银溶液中,反应是否有先后顺序?
【作出猜想】①铜粉先与硝酸银溶液反应 ②锌粉先与硝酸银溶液反应
【设计实验】①小晗取一定量铜粉和锌粉的混合物,放入少量的硝酸银溶液中,溶液的颜色没有发生变化,由此推断:铜粉与硝酸银溶液(填“发生”或“没发生”)反应.然后再向反应后的混合物中加入稀硫酸,发现无气泡产生,由此推断:锌粉与硝酸银溶液(填“发生”或“没发生”)反应.
②小晗再取同样的铁粉和锌粉混合物放入较多量的硝酸银溶液中,看到溶液变成蓝色,由此推断铜粉与硝酸银溶液(填“发生”或“没发生”)反应.
【分析并得出结论】综合上述实验现象可知,铜粉与锌粉的混合物放入一定量的硝酸银溶液中,锌粉优先与硝酸银溶液反应.
【反思】小晗分析得到蓝色溶液,对溶液中所含的溶质做出多种猜想,其中有两种猜想可能成立,这两种猜想是:①溶质为;②溶质为 .
(4)在探究实验后,为了测定某稀硫酸的质量分数,他们取铜粉和锌粉的混合物10克放入烧杯中,再取60克稀硫酸分6次加入烧杯中,均充分反应,实验数据如下:
次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | 第6次 |
加入稀硫酸的质量(g) | 10 | 10 | 10 | 10 | 10 | 10 |
剩余固体的质量 (g) | 9.35 | 8.70 | 8.05 | 7.40 | 6.75 | 6.75 |
根据上表提供的数据,求所用稀硫酸的质量分数.