题目内容
【题目】同学们发现将NaOH溶液和稀盐酸混合后没有明显现象,为了证明NaOH能与HCl发生中和反应,设计了如下实验:
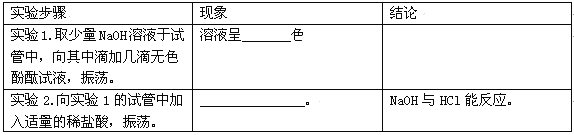
【解释与结论】写出NaOH与HCl反应的化学方程式______________。
【反思与评价】同学们对实验2反应后所得溶液的酸碱性进行讨论,小玲同学认为呈碱性,小生同学认为呈中性,小柏同学认为也可能呈酸性,最后同学们否定了小玲同学的说法,其理由是___;欲进一步确定实验2反应后所得溶液的酸碱性,其操作是__________。
【答案】

【解释与结论】NaOH + HCl == NaCl + H2O
【反思与评价】酚酞遇酸和中性溶液均呈无色;取实验2反应后的溶液少量于试管中,向其中滴加紫色石蕊。
【解析】
试题分析:证明NaOH能与HCl发生中和反应,设计了如下实验:步骤1.取少量NaOH溶液于试管中,向其中滴加几滴无色酚酞试液,振荡。溶液变为红色;步骤2,向实验1的试管中加入适量的稀盐酸,振荡,观察到红色褪去,说明氢氧化钠和盐酸发生反应;【解释与结论】NaOH与HCl反应的化学方程式NaOH + HCl == NaCl + H2O;【反思与评价】同学们对实验2反应后所得溶液的酸碱性进行讨论,小玲同学认为呈碱性,小生同学认为呈中性,小柏同学认为也可能呈酸性,最后同学们否定了小玲同学的说法,其理由是酚酞遇酸和中性溶液均呈无色,进一步确定实验2反应后所得溶液的酸碱性,其操作是取实验2反应后的溶液少量于试管中,向其中滴加紫色石蕊。

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目